网址:http://m.1010jiajiao.com/timu_id_4006073[举报]
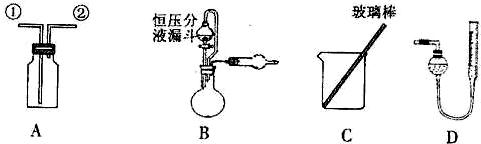
【实验一】收集NO气体.
(1)用装置A收集NO气体,正确的操作上
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d.从②口进气,用排气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数ωZn和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g.用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验.
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标.
(2)选用B和
(3)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)═
| 65V |
| 22.4m1 |
| 2.9V |
| m1 |
| 65V |
| 22.4m1 |
| 2.9V |
| m1 |
(4)计算镀层厚度,还需要检索的一个物理量是
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将
方案乙:通过称量试样与碱反应前后的质量实现探究目标.选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g.
(6)ω(Zn)=
| m1-m2 |
| m1 |
| m1-m2 |
| m1 |
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标.实验同样使用仪器C.
(7)从实验误差角度分析,方案丙

已知:①Ksp[Mg(OH)2]=6.0×10-12.②Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如下图所示.

(1)在盐泥中加入稀硫酸调pH为1~2以及第一次煮沸的目的是
(2)若溶液中Mg2+的浓度为6.0mol?L-1,则溶液pH≥
(3)第二次过滤需要趁热进行,主要原因是
(4)从滤液Ⅱ中获得MgSO4?7H2O晶体的实验步骤依次为:①向滤液Ⅱ中加入
(5)若获得的MgSO4?7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁元素的质量分数是
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4.00%的生铁
(3)煅烧硫铁矿常用富氧空气.从沸腾炉排出的气体成分如下表.如果精矿中铁、氧的物质的量之比为n (Fe):n(O)=5:7,则富氧空气中O2和N2的体积比(最简单的整数比)为
| 气体 | SO2 | N2 | O2 |
| 物质的量 | 10 | 58 | 6 |
A计算此钢样粉末中铁和碳的物质的量之比为
B再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
C若在上述实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(写出必要的步骤,答案保留3位小数).
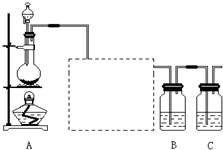 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:(1)装置A的分液漏斗中盛装的试剂是
(2)画出虚线框内的实验装置图,并注明所加试剂,


(3)装置B中盛放的试剂是
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.
(9分)某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律;同一周期内从左到右元素金属性的递变规律;同一主族内从上到下元素非金属的递变规律。
|
实验方法(Ⅰ) |
实验现象(Ⅱ) |
|
1、钠与冷水反应 |
a、溶液变红色 |
|
2、向NaOH溶液中滴加酚酞 |
b、产生白烟 |
|
3、向新制H2S饱和溶液滴加新制的氯水 |
c、反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
|
4、镁带在空气中燃烧 |
d、产生大量气泡、气体可以燃烧 |
|
5、NaI溶液中加入溴水和CCl4 |
e、下层溶液变橙色 |
|
6、镁带与沸水反应,再向反应后溶液中滴加酚酞。镁与2mol/L盐酸反应。 |
f、浮于水面,熔成小球,迅速向四处游动 |
|
7、蘸浓氨水与浓盐酸的两玻璃棒接近 |
g、下层溶液变紫色 |
|
8、NaBr溶液中加入氯水和CCl4 |
h、发出耀眼的强光,生成白色物质 |
|
9、铝片与2mnol/L盐酸反应 |
i、生成淡黄色沉淀 |
回答下列问题
(1)从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(有几个填几个,不一定把空格填满)。
|
|
1、探究同一周期从左到右元素金属性的递变规律 |
2、探究同一主族内从上到下元素非金属性的递变规律 |
||||||
|
Ⅰ |
|
|
|
|
|
|
|
|
|
Ⅱ |
|
|
|
|
|
|
|
|
(2)实验结论(表示元素具体的强弱顺序):
金属性:____________________ 非金属性:
(3)上表(Ⅰ)中实验方法9反应的离子方程式
(4)上表(Ⅱ)中实验现象e反应的离子方程式
查看习题详情和答案>>