摘要:考点阐释 化学与技术部分内容原来是穿插在了各个章节之中.并没有明确的考查要点.与各章节的内容合在一起进行考查.新课标中开设了化学与技术模块.主要分成了三大部分.①化学与资源开发利用.这一部分内容主要涉及到了煤.石油和天然气三种主要能源的开发与利用.海水的综合利用.废旧物资再生与综合利用三部分内容.②化学与材料的制造.应用.化学材料在原大纲中也有所体现.但不是很系统.在化学与技术模块中主要考查金属材料.无机非金属材料.高分子合成材料.复合材料和其他新材料的特点.③化学与工农业生产.这一部分内容在原大纲中不作要求.而在新课标中主要有水的处理.对合成氨的理解.肥料.农药等在农业生产中的作用. 化学与技术的内容与生产生活联系非常密切.在原来的高考题中往往以信息题的形式出现.题意往往比较新颖.考查的知识点比较综合.涉及到的知识点比较多.对学生的能力要求相对较高. 因为化学与技术只是一个选修模块.在高考中出题的形式是以填空或文字叙述的形式出现.而且只有一个题.所以试题的综合性较强.但难度不会很大.主要考查学生的“接受.吸收.整合化学信息的能力.分析问题和解决问题的能力.化学实验与探究能力 等三种能力.重点体现出新课程改革对于化学科的考核目标要求:“以能力测试为主导 .“注重测量自主学习的能力.重视理论联系实际 .
网址:http://m.1010jiajiao.com/timu_id_4004573[举报]
【化学_选修2化学与技术】
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
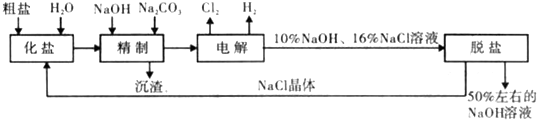
(1)在电解过程中,阳极的电极反应式为 与电源负极相连的电极附近.溶液pH 值 (选填“不变“、“升髙“或“下降“)
(2)铕制饱和食盐水时,为有效除去Ca2+、Mg2+、SO
,加入除杂试剂的合理顺序为 (选填a,b,c多选扣分),沉淀过滤后再加入HCl.
a.先加 NaOH,后加 Na2CO,再加 BaCl2 b.先加 NaOH,后加 BaCl2,再加 Na2CO3,
c.先加BaCl2,后加NaOH,再加Na2CO,d.先加Na2CO3,后加BaCl2,再加NaOH
写出沉淀过滤后,加入HCl时发生反应的离子方程式 .
(3)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅含一种溶质,相应的化学方程式为
(4)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4生产NaOH和H2SO4溶液的装置.从F口可不断充入Na2SO4.

请分析:①a为 (填“阳“或“阴“)离子交换膜;
②从D 口流出的溶液为 .(填溶质化学式)
查看习题详情和答案>>
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

(1)在电解过程中,阳极的电极反应式为
(2)铕制饱和食盐水时,为有效除去Ca2+、Mg2+、SO
2- 4 |
a.先加 NaOH,后加 Na2CO,再加 BaCl2 b.先加 NaOH,后加 BaCl2,再加 Na2CO3,
c.先加BaCl2,后加NaOH,再加Na2CO,d.先加Na2CO3,后加BaCl2,再加NaOH
写出沉淀过滤后,加入HCl时发生反应的离子方程式
(3)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅含一种溶质,相应的化学方程式为
(4)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4生产NaOH和H2SO4溶液的装置.从F口可不断充入Na2SO4.

请分析:①a为
②从D 口流出的溶液为
(2010?德阳模拟)[化学选修2:化学与技术]工业上为了使原料和能量得到充分的利用,常常采用循环操作.
Ⅰ、利用热化学循环制氢能缓解能源矛盾.最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢.MnFe2O4的制备:
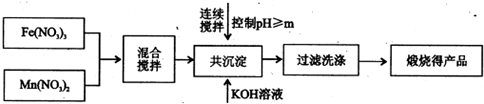
已知Fe3+、Mn2+沉淀的pH如表所示.
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为
(2)控制pH的操作中m的值为
Ⅱ、用MnFe2O4热化学循环制取氢气:MnFe2O4(s)
MnFe2O(4-x)(s)+
8O2(g);△H1=akJ/mol,
MnFe2O(4-x)(s)+xH2O(l)═MnFe2O4(s)+xH2(g);△H2=bkJ/mol,
(3)由上可知,H2燃烧的热化学方程式是
(4)该热化学循环制取氢气的优点是
A.过程简单、无污染 B.物料可循环使用 C.氧气和氢气在不同步骤生成,安全且易分离
Ⅲ、工业上可用H2、HCl通过如图的循环流程制取太阳能材料高纯硅.
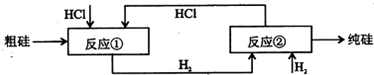
反应①Si(粗)+3HCl(g)
SiHCI3(l)+H2(g)
反应②:SiHCl3(l)+H2(g)
Si(纯)+3HCl(g)
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%.则在下一轮次的生产中,需补充投入HCl和H2的体积比是
查看习题详情和答案>>
Ⅰ、利用热化学循环制氢能缓解能源矛盾.最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢.MnFe2O4的制备:

已知Fe3+、Mn2+沉淀的pH如表所示.
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
2:1
2:1
.(2)控制pH的操作中m的值为
10.4
10.4
.Ⅱ、用MnFe2O4热化学循环制取氢气:MnFe2O4(s)
| ||
| x |
| 2 |
MnFe2O(4-x)(s)+xH2O(l)═MnFe2O4(s)+xH2(g);△H2=bkJ/mol,
(3)由上可知,H2燃烧的热化学方程式是
H2(g)+
O2(g)═H2O(l);△H=-
kJ/mol
| 1 |
| 2 |
| a+b |
| x |
H2(g)+
O2(g)═H2O(l);△H=-
kJ/mol
.| 1 |
| 2 |
| a+b |
| x |
(4)该热化学循环制取氢气的优点是
A、B、C
A、B、C
(填字母编号).A.过程简单、无污染 B.物料可循环使用 C.氧气和氢气在不同步骤生成,安全且易分离
Ⅲ、工业上可用H2、HCl通过如图的循环流程制取太阳能材料高纯硅.

反应①Si(粗)+3HCl(g)
| ||
反应②:SiHCl3(l)+H2(g)
| ||
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%.则在下一轮次的生产中,需补充投入HCl和H2的体积比是
3:1
3:1
.(2008?山东)化学-化学与技术
钢铁工业对促进经济和社会发展起了重要作用.
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在
(2)炼钢时,除磷的化学方程式为
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是
查看习题详情和答案>>
钢铁工业对促进经济和社会发展起了重要作用.
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在
炉身
炉身
部分发生反应,在炉腰
炉腰
部分开始生成生铁和炉渣.(2)炼钢时,除磷的化学方程式为
2P+5FeO+3CaO Ca3(P04)2+5Fe
Ca3(P04)2+5Fe
 Ca3(P04)2+5Fe
Ca3(P04)2+5Fe2P+5FeO+3CaO Ca3(P04)2+5Fe
Ca3(P04)2+5Fe
;加入硅、锰和铝的目的是 Ca3(P04)2+5Fe
Ca3(P04)2+5Fe脱氧和调整钢的成分
脱氧和调整钢的成分
.(3)不锈钢含有的Cr元素是在炼钢过程的氧吹
后
后
(填“前”或“后”)加入,原因是避免Cr被氧化
避免Cr被氧化
.(4)炼铁和炼钢生产中,尾气均含有的主要污染物是
CO
CO
.从环保和经济角度考虑,上述尾气经处理可用作燃料
燃料
.(2011?太原二模)[化学-化学与技术]硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
已知CuSO4 在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因
查看习题详情和答案>>
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
C
C
的郊区(填标号);A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为
4CuFeS2+13O2
4CuO+2Fe2O3+8SO2
| ||
4CuFeS2+13O2
4CuO+2Fe2O3+8SO2
.
| ||
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是
D
D
.A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少
SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少
.(2011?沈阳二模)化学----化学与技术模块
海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
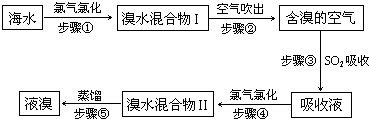
(1)步骤①反应的离子方程式是
(2)步骤③反应的化学方程式是
(3)Br的原子序数是
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃.温度过高或过低都不利于生产,请解释原因:
(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
查看习题详情和答案>>
海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:

(1)步骤①反应的离子方程式是
2Br-+Cl2=2Cl-+Br2
2Br-+Cl2=2Cl-+Br2
.(2)步骤③反应的化学方程式是
SO2+Br2+2H2O=2HBr+H2SO4
SO2+Br2+2H2O=2HBr+H2SO4
.(3)Br的原子序数是
35
35
,在周期表中位于4
4
周期ⅤⅡA
ⅤⅡA
族.(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃.温度过高或过低都不利于生产,请解释原因:
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低
.(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
溴水混合物I成分复杂,要获得溴需控制多个温度,操作麻烦
溴水混合物I成分复杂,要获得溴需控制多个温度,操作麻烦
.