摘要: 用铜片.银片.Cu (NO3)2溶液.AgNO3溶液.导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池.以下有关该原电池的叙述正确的是( ) ①在外电路中.电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag ③实验过程中取出盐桥.原电池仍继续工作 ④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同 A. ①② B.②③ C.②④ D.③④ [解析]选C.在外电路中.电流由正极银电极流向负极铜电极,取出盐桥.不能形成闭合回路.原电池不能继续工作,该原电池反应与铜片浸入AgNO3溶液中发生的化学反应都是Cu+ 2Ag+=2Ag+Cu2+.
网址:http://m.1010jiajiao.com/timu_id_4001727[举报]
(2010?东城区二模)某化学小组用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,其实验流程如下所示:

(1)步骤①中氧化铜与盐酸反应的离子方程式是
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是
(3)已知:
参照表中给出的数据和试剂,请回答:
步骤②的目的是
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2?2H2O,其原因是
查看习题详情和答案>>

(1)步骤①中氧化铜与盐酸反应的离子方程式是
CuO+2H+=Cu2++H2O
CuO+2H+=Cu2++H2O
.(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是
普通漏斗、玻璃棒、烧杯
普通漏斗、玻璃棒、烧杯
.(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2c.Na2CO3d.CuO | ||
步骤②的目的是
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.步骤③中调节溶液pH的范围是3.2至4.7
3.2至4.7
,试剂Y是d
d
(填字母).(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2?2H2O,其原因是
干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2?2H2O受热产生的水汽
干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2?2H2O受热产生的水汽
.(2010?清远模拟)Fridel-Crafts反应是向苯环上引入烷基最重要的方法,在合成上有很大的实用价值,该反应可以简单表示如下:ArH+RX
ArR+HX;△H<0(Ar表示苯基).某化学兴趣小组在实验室先利用叔丁醇与盐酸反应制得叔丁基氯(沸点50.7℃),再利用Fridel-Crafts反应原理制备对叔丁基苯酚(熔点99℃).反应流程及实验装置如下图所示:
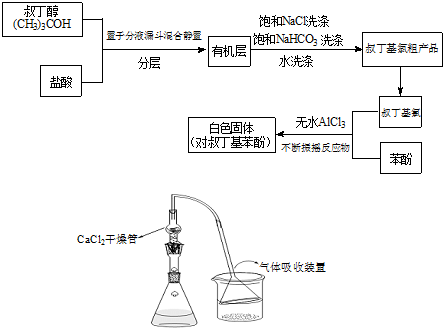
试回答下列问题:
(1)请写出本实验过程中的两个主要化学反应方程式: +(CH3)3CCl
+(CH3)3CCl
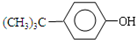 +HCl
+HCl +(CH3)3CCl
+(CH3)3CCl
 +HCl.
+HCl.
(2)有机层中加入饱和食盐水及饱和碳酸氢钠的作用可能是:
(3)若去掉该制备装置中的氯化钙干燥管,有可能导致的不良后果是(用化学方程式并配合文字说明):
(4)叔丁基氯与苯酚反应时适当控制温度是很重要的.若反应过程中温度过高应用冷水浴冷却,否则可能导致的不良后果是:
(5)常温下叔丁基氯易于发生消去反应故实验中所用的必须现用现配,试写出叔丁基氯发生消去反应的化学方程式:
(6)有时候最终产品对叔丁基苯酚不是白色而呈现紫色,你认为可能的原因是:
查看习题详情和答案>>
| 无水AlCl3 |

试回答下列问题:
(1)请写出本实验过程中的两个主要化学反应方程式:
(CH3)3COH+HCl→(CH3)3CCl+H2O
(CH3)3COH+HCl→(CH3)3CCl+H2O
, +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
 +HCl
+HCl +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
 +HCl
+HCl(2)有机层中加入饱和食盐水及饱和碳酸氢钠的作用可能是:
除去叔丁基氯粗产物中的HCl
除去叔丁基氯粗产物中的HCl
.通过蒸馏
蒸馏
操作可将叔丁基氯粗产物转化为较为纯净的叔丁基氯.(3)若去掉该制备装置中的氯化钙干燥管,有可能导致的不良后果是(用化学方程式并配合文字说明):
AlCl3+3H2O=Al(OH)3+3HCl↑,催化剂三氯化铝水解变质
AlCl3+3H2O=Al(OH)3+3HCl↑,催化剂三氯化铝水解变质
.(4)叔丁基氯与苯酚反应时适当控制温度是很重要的.若反应过程中温度过高应用冷水浴冷却,否则可能导致的不良后果是:
反应放热使温度升高,且生成大量的HCl气体,若不及时冷却,叔丁基氯的蒸气易逸出而影响产率
反应放热使温度升高,且生成大量的HCl气体,若不及时冷却,叔丁基氯的蒸气易逸出而影响产率
.(5)常温下叔丁基氯易于发生消去反应故实验中所用的必须现用现配,试写出叔丁基氯发生消去反应的化学方程式:
(CH3)3CCl→CH2=C(CH3)2+HCl↑
(CH3)3CCl→CH2=C(CH3)2+HCl↑
.(6)有时候最终产品对叔丁基苯酚不是白色而呈现紫色,你认为可能的原因是:
一部分苯酚被空气中的氧气所氧化
一部分苯酚被空气中的氧气所氧化
. (2010?东城区二模)一定条件下,物质A~E转化关系如右图,其中A为单质,常温下E为无色溶液体.
(2010?东城区二模)一定条件下,物质A~E转化关系如右图,其中A为单质,常温下E为无色溶液体.(1)若A、C、D均含氯元素,C为氯碱工业的原料,D溶液具有漂白性,则A与B反应的化学方程式是
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
;D溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是2I-+ClO-+H2O=I2+Cl-+2OH-
2I-+ClO-+H2O=I2+Cl-+2OH-
;检验C中所含阴离子的实验方法是取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-
取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-
.(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体.A与B反应的化学方程式是
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
;a mol A与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是
| ||
a mol≤n(NaOH)≤2a mol
a mol≤n(NaOH)≤2a mol
.(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液,探究使褪色的物质的实验方法是
取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色
取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色
.(2010?辽宁二模)A、B、C、D是由下面的一种阳离子和一种阴离子组成的化合物(阳离子:
、Na+、H+,阴离子:Cl-、OH-、
),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:

(1)根据图1的PH变化关系写出化学式:A
(2)B与过量的D反应生成E,写出该反应的离子方程式
(3)E的溶液显
(4)图2是室温时向25mL某浓度的C溶液中逐渐滴加O.25mol/L,A溶液过程中PH的变化曲线.G点呈中性,此时,V(A)的体积
(5)已知BaC2O4的溶度积常数KSP=1.6×10-7.向0.01mol/L的Na2C2O4溶液中加入等体积一定浓度的BaCl2溶液,若要产生沉淀,BaCl2溶液浓度至少为
查看习题详情和答案>>
| NH | + 4 |
| C2O | 2- 4 |

(1)根据图1的PH变化关系写出化学式:A
NH3?H2O
NH3?H2O
,CHCl
HCl
.(2)B与过量的D反应生成E,写出该反应的离子方程式
H2C2O4+OH-=HC2O4-+H2O
H2C2O4+OH-=HC2O4-+H2O
.(3)E的溶液显
酸
酸
(填“中性”、“酸性”或“碱性”),其原因是HC2O4-的电离程度大于水解程度
HC2O4-的电离程度大于水解程度
.(4)图2是室温时向25mL某浓度的C溶液中逐渐滴加O.25mol/L,A溶液过程中PH的变化曲线.G点呈中性,此时,V(A)的体积
>
>
10Ml(填“=”、“>”或“<”).H点离子浓度由大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+)
c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+)
.(5)已知BaC2O4的溶度积常数KSP=1.6×10-7.向0.01mol/L的Na2C2O4溶液中加入等体积一定浓度的BaCl2溶液,若要产生沉淀,BaCl2溶液浓度至少为
3.2×10-5mol/L
3.2×10-5mol/L
.(2010?清远模拟)下表为短周期元素①~⑧的部分性质,下列说法正确的是( )
|
查看习题详情和答案>>