摘要:北京大学教授.著名的化学家和教育家徐光宪教授.是我国理论化学和稀土化学的奠基人之一.2008年获得“国家最高科学技术奖 .以表彰他在稀土理论方面作出的贡献.稀土铈(Ce)元素主要存在于独居石中.金属铈在空气中易氧化变暗.受热时燃烧.遇水很快反应并产生气体.已知:铈常见的化合价为+3和+4.且Ce4++Fe2+=Ce3++Fe3+.下列说法正确的是( ) A.用Pt作阴极.Fe作阳极.电解熔融CeO2.可在阳极获得铈 B.将少量的碘化亚铁溶液滴加到Ce(SO4)2溶液中.其离子方程式为: Ce4++Fe2+=Ce3++Fe3+ C.金属铈着火.可采用普通的泡沫灭火器灭火 D.金属铈可浸于煤油中保存.储存在阴凉.通风的地方.要远离火种和热源 [解析]选D.A项.Fe作阳极.阳极Fe被氧化成Fe2+后又发生反应Ce4++Fe2+=Ce3++Fe3+.不能得到铈,B项. I-还原性比Fe2+强.除Fe2+被氧化外.I-可被Ce4+氧化成I2 ,C项.铈可与水很快反应并产生气体.着火不可用普通的泡沫灭火器灭火,D项.铈在空气中易氧化.受热时燃烧.以与水反应.所以.应密封.放置阴凉处保存.并远离火源.
网址:http://m.1010jiajiao.com/timu_id_4001713[举报]
 (2010?中山模拟)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同).试回答:
(2010?中山模拟)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同).试回答:(1)此实验中,观察到的现象有:
①
溶液里有白色沉淀产生
溶液里有白色沉淀产生
;②小球下沉到烧杯底
小球下沉到烧杯底
.(2)写出实验过程中反应的离子方程式为
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
. (2010?安徽模拟)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.
(2010?安徽模拟)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH);②
2Fe(OH)3+3ClO-+10OH-=2FeO2-4+3Cl-+5H2O
2Fe(OH)3+3ClO-+10OH-=2FeO2-4+3Cl-+5H2O
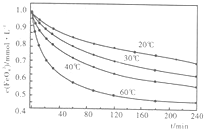
.(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物.将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4)=1.0mmol?L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO+2-4)的变化,结果见图.高铁酸钾与水反应的离子反应方程式为
4FeO2-4+10H2O=4Fe(OH)3+8OH-+3O2↑
4FeO2-4+10H2O=4Fe(OH)3+8OH-+3O2↑
,该反应的△H>
>
0(填“>”“<”或“=”).(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
| 放电 |
| 充电 |
Zn+2OH--2e-=Zn(OH)
Zn+2OH--2e-=Zn(OH)
,若外电路有5.418×1022个电子通过,则正极有5.94
5.94
g高铁酸钾参与反应.(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-7,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol?L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL.
①滴定时发生反应的离子方程式为
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
.②原溶液中K2FeO4的浓度为
| cV1 |
| 3V |
| cV1 |
| 3V |