网址:http://m.1010jiajiao.com/timu_id_4001222[举报]
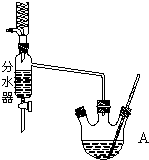 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题:(1)揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯.请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
②能否用氢同位素示踪法揭示酯化反应原理?
(2)反应温度确定:
合成乙酸乙酯的反应为放热反应.实验表明,反应温度应控制在85℃左右为宜.回答:
实验温度不宜低于85℃左右的原因是
实验温度不宜高于85℃左右的原因是
(3)实验装置的比较:
利用图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是
(4)酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴
第一步:连接好装置,检验气密性,在各仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,并用蒸馏水洗涤晶体,得到NaHCO3固体。
第四步:向滤液中通氨气,加入细小食盐颗粒,冷却析出副产品NH4Cl晶体。
请回答下列问题:

(1)装置的接口连接时a接_____________。
D中所盛试剂的名称是_____________。
(2)第二步中必须先让_____________(填编号)装置发生反应。
(3)C中用球形干燥管而不用直导管,其作用是___________________________,C中广口瓶内产生固体的总化学方程式为______________________________。
(4)第三步中用蒸馏水洗涤晶体的目的是除去______________________________杂质(以化学式表示)。
(5)向滤液中通氨气的目的是_____________。(填序号)
a.增大![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用上述HCl溶液滴定至溶液由黄变橙,又用去HCl溶液的体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用上述HCl溶液滴定至溶液由黄变橙,又用去HCl溶液的体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
w(NaHCO3)=________________________________________________。
查看习题详情和答案>>