网址:http://m.1010jiajiao.com/timu_id_3998441[举报]

(1)①废水I若采用CO2处理,离子方程式是
②废水Ⅱ常用明矾处理.实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为
③废水Ⅲ中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++
我国规定,Hg2+的排放标准不能超过0.05mg/L.若某工厂排放的废水1L中含Hg2+3×10-7mol,是否达到了排放标准
④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液.
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热.
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液 滴定.终点时消耗硫酸亚铁铵溶液V2 mL.
①I中,量取K2Cr207,溶液的仪器是
②Ⅱ中,碎瓷片的作用是
③Ⅲ中,发生的反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3+7H2O由此可知,该水样的化学需氧量COD=
| 8000×(15-cV2) |
| V1 |
| 8000×(15-cV2) |
| V1 |
(1)据报道,北江水污染事件是由于某冶炼厂设备检修期间排放的废水所致,推测其主要污染物是
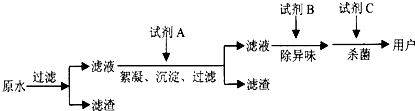
(2)自来水的生产流程如图,其中的试剂A、B、C分别可以选择
(3)电镀厂排放的废水中含铬(以Cr2O72-形式存在),常用电解的方法处理.电解时,以铁为阳极,生成的Fe2+将Cr2O72-还原为Cr3+,产物再与电解时生成的OH-形成氢氧化物沉淀而除去.
①两个电极上发生的反应分别为:阳极
②溶液中发生的总反应为(用离子方程式表示)
(4)化学需氧量(COD)是水体质量的控制项目这一,它是量废水中还原性污染物的重要指标.COD是指用强氧化剂(我国采用K2Cr2O7)处理一定量水样时消耗的氧化剂的量,并换算成以O2作为氧化剂时,1L水样所消耗O2的质量(mg?L-1).现取某池塘水样20.00mL,反应消耗10.00mL0.0400mol?L-1K2Cr2O7溶液(反应后转化为Cr3+).该水样的COD为
 根据废水中所含有害物质的不同,工业上有多种废水的处理方法.
根据废水中所含有害物质的不同,工业上有多种废水的处理方法.(1)①废水Ⅰ呈碱性,若采用CO2处理,发生反应的离子方程式是
②废水Ⅱ常用明矾处理.实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为
③废水Ⅲ中的汞元素存在如下转化:Hg2++CH4═CH3Hg++H+,我国规定,Hg2+的排放标准不能超过0.05mg/L.若某工厂排放的废水1L中含Hg2+3×10-7mol,是否达到了排放标准
④废水Ⅳ常用Cl2氧化CN-成CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取V1 mL水样于锥形瓶,加入10.00mL 0.2500mol/L K2Cr2O7溶液.
Ⅱ.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热.
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定.终点时消耗硫酸亚铁铵溶液V2 mL.
①Ⅱ中,碎瓷片的作用是
②Ⅲ中,发生的反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.由此可知,该水样的化学需氧量COD=
| 8000×(15-cV2) |
| V1 |
| 8000×(15-cV2) |
| V1 |
工业制备氯化铜时,将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整溶液pH=9.6,将Fe2+沉淀除去? ,(填“能” 或“不能”)理由是 ,
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的PH将Fe3+沉淀除去:
①加入NaClO后,溶液的pH变化是________(填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? ,(填“是” 或“否”)现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个,填代号)。
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的___________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
查看习题详情和答案>>
(16分)(2011·黄冈中学质检)工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?________,理由是________________________________________________________________________,
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是________(填代号)。
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?________,理由是_____________________。
现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个)。
A.浓HNO3 B.KMnO4
C.Cl2 D.O2
E.H2O2
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________。(多选不限)
A.NaOH B.氨水
C.Cu2(OH)2CO3 D.Na2CO3
E.CuO F.Cu(OH)2