摘要:(三)突出实验教学 尽可能创造条件进行学生分组实验.加强感性认识.发挥实验的学科功能.同时创造机会让学生体验实验探究的过程和获得成功的喜悦.培养学习化学的兴趣.
网址:http://m.1010jiajiao.com/timu_id_3998383[举报]
 第29届奥运会祥云火炬的外壳材料是高强度的铝镁合金.某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:
第29届奥运会祥云火炬的外壳材料是高强度的铝镁合金.某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:方案一:铝镁合金
| NaOH溶液 |
方案二:铝镁合金
| 盐酸 |
方案三:铝镁合金
| 盐酸 |
| 过量NaOH溶液 |
| 过滤、洗涤、烧灼、冷却 |
(1)写出方案一中发生反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(2)实验小组根据方案二设计了两个实验装置,如图1(图中的铁架台已省略).
你认为选择
乙
乙
(选填甲或乙)装置进行实验更合理,误差更小.(3)用方案三进行实验时,除了称量灼烧产物质量外,还需称量的是
合金样品的质量
合金样品的质量
.(4)拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示:
请你判断,根据图2数轴申的数据能否求出合金中镁的质量分数?
能
能
(选填“能”或“不能”)下列①②两题选一题作答.
①若不能求出合金中镁的质量分数,请说明理由
不填
不填
.②若能求出合金中镁的质量分数,则镁的质量分数为
30.8%
30.8%
.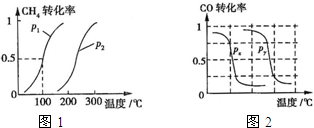 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)…I.CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.003mol/(L?min)
0.003mol/(L?min)
.②图中的P1
<
<
P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4
2.25×10-4
.③该反应的△H
>
>
0(填“<”、“>”或“=”).(2)在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0
Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是
BD
BD
.A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) | ||
| l | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
150
150
、b=| 1 |
| 3 |
| 1 |
| 3 |
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=
0.1
0.1
MPa. 工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
方案二:用0.100mol/L盐酸滴定.
方案三用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作.称量时所需定量实验仪器为
电子天平
电子天平
.判断是否达到恒重的标准是前后两次称量的质量差不超过0.001g
前后两次称量的质量差不超过0.001g
.(2)方案二的具体过程如图甲:
①操作1所需要的仪器有
烧杯、玻璃棒、100mL容量瓶、胶头滴管
烧杯、玻璃棒、100mL容量瓶、胶头滴管
.②滴定时选择的指示剂为甲基橙.当溶液
黄色恰好变成橙色,且半分钟内不褪色
黄色恰好变成橙色,且半分钟内不褪色
时,说明达到了滴定终点.③为减少偶然误差,通常的处理办法是
做2-3次平行实验
做2-3次平行实验
.④滴定时若锥形瓶内有少量液体溅出,则测定结果
偏低
偏低
.(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果不影响
不影响
.(3)方案三的实验装置如图乙:操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.该方案样品中纯碱的质量分数为
| 53(W3-W1) |
| 22W2 |
| 53(W3-W1) |
| 22W2 |
吸收空气中的二氧化碳
吸收空气中的二氧化碳
.装置C的作用是吸收二氧化碳中的水蒸气
吸收二氧化碳中的水蒸气
.有同学认为空气中的水蒸气会进入干燥管导致测量结果偏大
偏大
(填“偏大”、“偏小”或“无影响”).改进措施可以是在干燥管右边再加一个装有碱石灰的干燥管
在干燥管右边再加一个装有碱石灰的干燥管
.(4)若用如图丙装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量.则下列装置中,最合理的是
B
B
.(选填序号)
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 .
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 .
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2: .
实验3:进行实验以确定可能的原因.
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
你认为实验4设计的主要目的是 .
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe2+ 的能力逐渐减弱,用原子结构解释原因: .
查看习题详情和答案>>
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:
实验3:进行实验以确定可能的原因.
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe2+ 的能力逐渐减弱,用原子结构解释原因:
“温室效应”是全球关注的环境问题之一,科学家们一直致力于CO2的“组合转化”技术研究.例如将CO2和H2以1:4或1:3的比例混合,在适当条件下反应,生成H2O的同时可分别获得重要的气态能源物质A和对植物生长有调节作用的有机物B.请回答下列问题:
(1)写出生成A的化学方程式:
(2)某小组做了如下三组对照实验来证实有机物B对植物生长的调节作用.
实验序号:①集气瓶中放青色、未熟的水果,在空气中盖上玻璃片.
实验序号:②集气瓶中放青色、未熟的水果,通入一定量的有机物B.
实验序号:③集气瓶中放青色、未熟的水果,瓶底放少量KMnO4 固体.
该三组实验中,水果成熟的先后顺序为
(3)A分子的空间构型为
(4)试推测丙烯(CH2=CH-CH3)的结构或性质,下列说法中不正确的是
a.丙烯与氯化氢反应只有一种产物
b.丙烯可使酸性高锰酸钾溶液褪色
c.丙烯可使溴水褪色
d.丙烯能发生加成反应.
查看习题详情和答案>>
(1)写出生成A的化学方程式:
CO2+H2=CH4+2H2O
CO2+H2=CH4+2H2O
(不必写反应条件)(2)某小组做了如下三组对照实验来证实有机物B对植物生长的调节作用.
实验序号:①集气瓶中放青色、未熟的水果,在空气中盖上玻璃片.
实验序号:②集气瓶中放青色、未熟的水果,通入一定量的有机物B.
实验序号:③集气瓶中放青色、未熟的水果,瓶底放少量KMnO4 固体.
该三组实验中,水果成熟的先后顺序为
②①③
②①③
.(填实验序号)(3)A分子的空间构型为
正四面体
正四面体
.(4)试推测丙烯(CH2=CH-CH3)的结构或性质,下列说法中不正确的是
a
a
(填字母)a.丙烯与氯化氢反应只有一种产物
b.丙烯可使酸性高锰酸钾溶液褪色
c.丙烯可使溴水褪色
d.丙烯能发生加成反应.