摘要:(一). 根据反应现象推知官能团 1.能使溴水褪色.可推知该物质分子中可能含有碳碳双键.三键或醛基. 20090318 2.能使酸性高锰酸钾溶液褪色.可推知该物质分子中可能含有碳碳双键.三键.醛基或为苯的同系物. 3.遇三氯化铁溶液显紫色.可推知该物质分子含有酚羟基. 4.遇浓硝酸变黄.可推知该物质是含有苯环结构的蛋白质. 5.遇水变蓝.可推知该物质为淀粉. 6.加入新制氢氧化铜悬浊液.加热.有红色沉淀生成,或加入银氨溶液有银镜生成.可推知该分子结构有即醛基.则该物质可能为醛类.甲酸和甲酸某酯. 7.加入金属Na放出.可推知该物质分子结构中含有. 8.加入溶液产生气体.可推知该物质分子结构中含有. 9.加入溴水.出现白色沉淀.可推知该物质为苯酚或其衍生物.
网址:http://m.1010jiajiao.com/timu_id_3997155[举报]
有A、B、C、D四种可溶性盐,它们分别是AgNO3、CuSO4、Na2CO3、BaCl2中的一种,现进行如下实验:
①若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色.②若向①的四支试管中分别加盐酸,B的溶液有沉淀产生,D的溶液有无色无味的气体逸出.根据①、②实验事实,回答下列问题:
(1)写出下列物质的化学式:
A.
(2)写出实验②中有关反应的离子方程式:
查看习题详情和答案>>
①若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色.②若向①的四支试管中分别加盐酸,B的溶液有沉淀产生,D的溶液有无色无味的气体逸出.根据①、②实验事实,回答下列问题:
(1)写出下列物质的化学式:
A.
BaCl2
BaCl2
B.AgNO3
AgNO3
C.CuSO4
CuSO4
D.Na2CO3
Na2CO3
(2)写出实验②中有关反应的离子方程式:
Ag++C1-=AgCl↓
Ag++C1-=AgCl↓
;CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
.氮化铝(AlN)是一种新型无机材料,广泛应用与集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计).
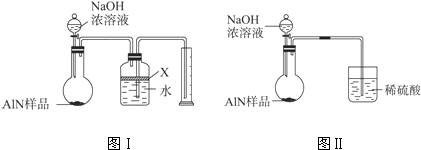
(1)实验有关操作为:a、往烧瓶中放入适量的AlN样品;b、从分液漏斗往烧瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为 .
(2)本试验中检查装置气密性的方法是 .
(3)广口瓶中的试剂X可选用 (填选项的标号).
A.浓氢氧化钠溶液 B.酒精 C.植物油 D.CCl4
(4)广口瓶中液体未装满,测得NH3的体积将 (填“偏大”、“偏小”或“无影响”).
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是 .
(6)若样品的质量为w g,氨气的体积为a L(标准状况),AlN的质量分数为 .
查看习题详情和答案>>

(1)实验有关操作为:a、往烧瓶中放入适量的AlN样品;b、从分液漏斗往烧瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为
(2)本试验中检查装置气密性的方法是
(3)广口瓶中的试剂X可选用
A.浓氢氧化钠溶液 B.酒精 C.植物油 D.CCl4
(4)广口瓶中液体未装满,测得NH3的体积将
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
(6)若样品的质量为w g,氨气的体积为a L(标准状况),AlN的质量分数为
(1)有A、B、C、D四种未知溶液,已知它们分别是NaHSO4、NaHCO3、BaCl2、Na2SO4四种溶液中的一种,现进行如下表所示的实验,根据现象,试确定B、C、D各是什么物质.
(2)现有下列四组溶液,每组包括三种溶液并按X、Y、Z的顺序排列:
请根据下列操作中所观察到的现象回答问题.
①向CaCl2溶液中加入X溶液,产生白色沉淀;然后加入过量的Y溶液,沉淀消失,并产生无色无味的气体;再加入少量的Z溶液,又生成白色沉淀.
②上述操作过程中,选用了
③最后一步反应的离子方程式是
查看习题详情和答案>>
| 实验 | 反应现象 | 结论 |
| A+B | 产生无色气体 | B是 NaHCO3 NaHCO3 |
| A+C | 无明显现象 | C是 Na2SO4 Na2SO4 |
| A+D | 产生白色沉淀 | D是 BaCl2 BaCl2 |
| 甲组 | 乙组 | 丙组 | 丁组 | |
| X | BaCl2 | Na2CO3 | KCl | K2CO3 |
| Y | 硝酸 | 硝酸 | 盐酸 | 盐酸 |
| Z | Na2CO3 | AgNO3 | K2CO3 | BaCl2 |
①向CaCl2溶液中加入X溶液,产生白色沉淀;然后加入过量的Y溶液,沉淀消失,并产生无色无味的气体;再加入少量的Z溶液,又生成白色沉淀.
②上述操作过程中,选用了
乙
乙
组溶液.③最后一步反应的离子方程式是
Ag++Cl-=AgCl↓
Ag++Cl-=AgCl↓
.A、B、C、D四种可溶性盐,知其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3-中的某一种.现做以下实验:
①将四种盐各取少量,分别溶于盛有5mL蒸馏水的四支试管中,只有B盐溶液呈蓝色.
②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象.
(1)根据上述事实,推断这四种盐的化学式分别为:
A
(2)写出实验步骤②中涉及到的所有反应的离子方程式:
查看习题详情和答案>>
①将四种盐各取少量,分别溶于盛有5mL蒸馏水的四支试管中,只有B盐溶液呈蓝色.
②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象.
(1)根据上述事实,推断这四种盐的化学式分别为:
A
AgNO3
AgNO3
BCuSO4
CuSO4
CNa2CO3
Na2CO3
DBaCl2
BaCl2
(2)写出实验步骤②中涉及到的所有反应的离子方程式:
Ag++Cl-=AgCl↓,CO32-+2H+=CO2↑+H2O
Ag++Cl-=AgCl↓,CO32-+2H+=CO2↑+H2O
.