摘要:用打气筒将空气压入自行车胎内.主要是因为 A.气体分子很小 B.气体分子间距离较大 C.气体分子可分 D.气体分子在不断运动
网址:http://m.1010jiajiao.com/timu_id_3995824[举报]
小青在实验室发现一瓶长期敞口放置的浓盐酸,为方便以后使用,他对其浓度进行了测定.取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)测定溶液的pH,得到的数据如下:
(1)请你绘制出烧杯中溶液的pH与加入氢氧化钠溶液体积(V)之间的变化关系图.
(2)请根据上图找出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积数,并据此计算此瓶盐酸的溶质质量分数.(氢氧化钠溶液的密度按1.0g/mL计算) 查看习题详情和答案>>
| 加入氢氧化钠的体积/mL | 0 | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 |
| 烧杯中溶液的pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |

(2)请根据上图找出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积数,并据此计算此瓶盐酸的溶质质量分数.(氢氧化钠溶液的密度按1.0g/mL计算) 查看习题详情和答案>>
2006年10月12日“神舟六号”成功升天并顺利返回,标志着我国航天事业的新跨越.
(1)火箭推进器中盛有强还原剂联氨(N2H4)和双氧水(H2O2),它们混合时产生水蒸气和一种单质,并放出大量的热,其反应的化学方程式为
(2)宇宙飞船中用来除去二氧化碳的物质是氢氧化锂( LiOH ),其反应原理是
查看习题详情和答案>>
(1)火箭推进器中盛有强还原剂联氨(N2H4)和双氧水(H2O2),它们混合时产生水蒸气和一种单质,并放出大量的热,其反应的化学方程式为
N2H4+2H2O2═N2+4H2O
N2H4+2H2O2═N2+4H2O
;将联氨作推进器中燃料的一个很大优点是污染少
污染少
.(2)宇宙飞船中用来除去二氧化碳的物质是氢氧化锂( LiOH ),其反应原理是
CO2+2LiOH=Li2CO3+H2O
CO2+2LiOH=Li2CO3+H2O
;用氢氧化锂而不用其他物质(如氢氧化钠)的原因是(通过计算说明)吸收等质量的CO2所需要的LiOH比NaOH少得多
吸收等质量的CO2所需要的LiOH比NaOH少得多
.气体的实验室制法是一种重要的实验基本技能,请回顾二氧化碳的实验室制法,回答下列问题:
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
CO2
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
CaO+CO↑+CO2↑
⑤CO+Fe2O3
2Fe+3CO2
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:
(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
①分析上述数据可得到一个结论:
②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸
(3)下面是二氧化碳的制取、净化、收集和量气的相关实验
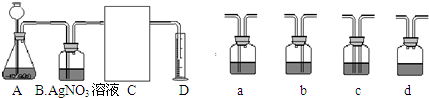
(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是
②实验过程B装置产生的主要实验现象是:
涉及化学反应是
③方线框中的C装置应该选择上面提供的a、b、c、d的
查看习题详情和答案>>
(1)化学反应能生成二氧化碳的反应很多,如见下面反应
①C+O2
| ||
②Na2CO3+2HCl=2NaCl+H20+CO2↑
③CaCO3+2HCl=2CaCl2+H20+CO2↑
④CaC2O4
| ||
⑤CO+Fe2O3
| ||
…
请任意分析上面一个不适合于实验制取二氧化碳的反应的原因:
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
反应②Na2CO3+2HCl═2NaCl+H20+CO2↑该反应速率太快,不利于收集
.现提供有①纯净的CaCO3白色粉末,②大理石,③稀盐酸,③浓盐酸,④稀硫酸,⑤浓硫酸.其中最适合用于实验室制取二氧化碳的药品是②③
②③
(填代号)(2)盐酸密度(20℃时)和其溶质质量分数之间的关系
| 密度(ρ)/g?ml-1 | 1.00 | 1.02 | 1.04 | 1.06 | 1.08 | 1.10 | 1.12 | 1.14 | 1.16 | 1.185 |
| 溶质质量分数(w)/% | 0.4 | 4.4 | 8.5 | 12.5 | 16.5 | 20.4 | 24.2 | 28.2 | 32.2 | 37.2 |
溶液质量分数越大,其密度也越大
溶液质量分数越大,其密度也越大
;盐酸是氯化氢气体溶于水得到的溶液,升高盐酸溶液的温度,其密度将变减小
减小
.②现要配制200ml溶质质量分数为8.5%的稀盐酸用于制取二氧化碳,则需要溶质质量分数为37.2%的浓盐酸
40.1mL
40.1mL
ml.配制过程中要用到量筒、胶头滴管
胶头滴管
、烧杯、玻璃棒等仪器.(3)下面是二氧化碳的制取、净化、收集和量气的相关实验

(温馨提示:C装置中装饱和碳酸氢钠溶液,二氧化碳不溶于饱和碳酸氢钠溶液)
①A中的长颈漏斗如果用分液漏斗代替的好处是
分液漏斗比长颈漏斗能更方便的控制反应速率
分液漏斗比长颈漏斗能更方便的控制反应速率
②实验过程B装置产生的主要实验现象是:
产生白色沉淀
产生白色沉淀
;涉及化学反应是
AgNO3+HC═lAgCl↓+HNO3
AgNO3+HC═lAgCl↓+HNO3
.③方线框中的C装置应该选择上面提供的a、b、c、d的
a
a
.
 一定条件下,某物质溶解于水的实验数据如表,请回答有关问题.
一定条件下,某物质溶解于水的实验数据如表,请回答有关问题.