网址:http://m.1010jiajiao.com/timu_id_3993443[举报]
________氢氧化钠溶液体积(填“ >” 或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液,溶液中c(Na+)________c(CH3COO-)
(填“ >” 或“=”或“<”)。
(3)某温度(t℃)时,水的Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,若所得混合溶液为中性,则a:b=_________;若所得混合溶液pH=2,则a:b=__________。
(4)室温下,若某pH值的硫酸溶液中水电离出的c(H+)=1.0×10-amol·L-1,而相同pH值的硫酸铝溶液中水电离出的c(H+)=1.0×10-bmol·L-1,(已知a,b均为小于14的正整数),那么a和b之间满足的数量关系是__________________。(用一个等式和一个不等式表示)。
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。

图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
|
温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。
查看习题详情和答案>>
如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。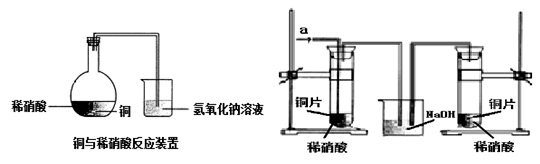
图 1 图 2
(1)图1中铜与稀硝酸反应的离子方程式为 ;
用离子方程式表示NaOH溶液所起的作用 ;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是 ;
测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是 ;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的 (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量 生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论) 。 查看习题详情和答案>>
 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.(1)铝元素在元素周期表中的位置是
(2)铝电池性能优越,铝-空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.
①该电池的总反应化学方程式为
②电池中的NaCl的作用为
③以铝-空气电池为电源电解kl溶液制取KlO3(石墨为电极材料)时,电解过程中阳极的电极反应式为
④某铝一空气电池的效率为50%,若用其作电源电解500ml的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3mol?L-1,则该过程中消耗铝的质量为
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理.
①氯化铝矿粉在加热条件下易升华,气态氯化铝的化学式Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为


②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
| ||
| ||

(1)如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递HH+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
| ||
| (一定条件) |
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=| C(N2)?[C (H2) ]3 |
| [C (NH3)]2 |
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
①试确定K1的相对大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据的是
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故.则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为
A.C(Cl-)>C(NH4+)>C(H+)>C(OH-)
B.C(NH4+)>C(Cl-)>C(OH-)>C(H+)
C.C(Cl-)>C(NH4+)>C(OH-)>C(H+)
D.C(NH4+)>C(Cl-)>C(H+)>C(OH-)