摘要:根据课程标准所确定的“内容标准 .在必修课程的6个主题“认识化学科学 “化学实验基础 “常见无机物及其应用 “物质结构基础 “化学反应与能量 “化学于可持续发展 中.“化学实验基础 是必修内容的核心.化学是一门以实验为基础的学科.要让学生学好化学.首先要让学生了解化学学科的这一特征.并引导学生通过化学实验去学习化学.实验是了解无机物性质的最好方法.也是认识元素周期律的最佳途径,通过实验可以感受化学反应与能量的关系.认识并研究能量的利用问题,通过实验还能切实了解材料.环境.绿色化学等问题.本章体现了课程标准所反映的教学理念. 教科书不仅把“化学实验 作为专题内容.还把它安排在第一章.突出了化学实验的基础性.实验内容的设置上考虑了学生的基础.由复习巩固到加深拓展(实验室完整的蒸馏操作.粗盐提纯后涉及的离子检验问题)到新知识的学习由已知到未知.由简单到复杂.逐步深入.这样即起到与初中化学实验以及化学知识的衔接.又为高中化学新知识的学习穿针引线.通过实验把学生引入化学世界. 第二节中涉及摩尔.气体摩尔体积.物质的量浓度的概念.物质的量.摩尔质量.一定物质的量浓度溶液的配制方法等化学学习过程中研究和认识化学的基本工具.为后面的学习奠定基础.由此决定了本章教学内容的基础性和重要性.
网址:http://m.1010jiajiao.com/timu_id_3993359[举报]
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为
(2)这样制取的二氧化硫气体中可能含有的杂质是
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是
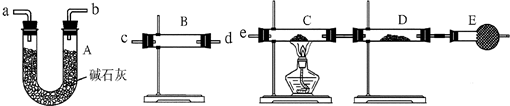
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
查看习题详情和答案>>
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
.(2)这样制取的二氧化硫气体中可能含有的杂质是
氢气和水蒸气
氢气和水蒸气
;原因是随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,同时会有少量水蒸气
随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,同时会有少量水蒸气
.(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是
cd(或dc)ab(或ba)e
cd(或dc)ab(或ba)e
(用a、b…填写).
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | 无水硫酸铜 无水硫酸铜 |
固体由白色变成蓝色 固体由白色变成蓝色 |
SO2中含有水蒸气 SO2中含有水蒸气 |
| C | CuO固体 | C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色 C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色 |
SO2中含有氢气 SO2中含有氢气 |
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 .
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
①若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”.下同);若温度不变,提高投料比[n(H2)/n(CO2)],则K将 .
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式 .
③在②所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12L?min-1(标准状况),并以该电池作为电源电解2mol?L-1CuSO4溶液500mL,则通电30s后理论上在阴极可析出金属铜 g.
查看习题详情和答案>>
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+6H2(g)
| 催化剂 |
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
③在②所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12L?min-1(标准状况),并以该电池作为电源电解2mol?L-1CuSO4溶液500mL,则通电30s后理论上在阴极可析出金属铜
 (2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2 (g)?CH3OH (g)△H1
反应Ⅱ:CO2(g)+3H2 (g)?CH3OH (g)+H2O (g)△H2
①上述反应符合.“原子经济”原则的是
Ⅰ
Ⅰ
(填“Ⅰ”或“Ⅱ”);②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
<
<
0(填“>”、“=”或“<”),反应Ⅰ的平衡常数的表达式是| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,按反应Ⅰ充分反应达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为
80%
80%
.(2)根据如图所示的能量变化写出由碳转化成CO的热化学方程式
C(s)+1/2O2(g)=CO (g)△H=-110.6 kJ/mol
C(s)+1/2O2(g)=CO (g)△H=-110.6 kJ/mol
.(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下1图:

①写出甲中通入甲醇这一极的电极反应式
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.③理论上乙中两极所得气体的体积随时间变化的关系如题2图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
;在t2时所得溶液的pH约为1
1
.(溶液体积变化忽略不计) 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( ) (2011?湖南模拟)根据如图所示的装置,判断下列说法正确的是( )
(2011?湖南模拟)根据如图所示的装置,判断下列说法正确的是( )