摘要:5mol×27g/mol=13.5g 所以答案为C.D. 例4.在0.2mol/L的AlCl3溶液100mL中.如果要得到1.17g沉淀.则需加入-0.5mol/L的NaOH溶液多少毫升? 解法一:AlCl3与NaOH反应时.当AlCl3过量时.只生成Al(OH)3.当NaOH 过量时.Al(OH)3沉淀又会部分溶解.所以.此题应有两种结果. (1)当AlCl3过量时.设需加入xmolNaOH溶液才能得到1.17gAl(OH)3沉淀. -Al3++3OH-══Al(OH)3↓ -3mol -1mol - -解之得:x=90mL (2)当NaOH过量时.设需加入ymLNaOH溶液才能得到1.17gAl(OH)3沉 -淀. -Al3+-+ 3OH-══Al(OH)3↓ -1mol 3mol -1mol
网址:http://m.1010jiajiao.com/timu_id_3990943[举报]
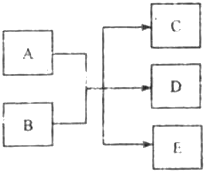 (2011?河西区一模)在一定条件下,物质A~E相互转化的关系如下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):
(2011?河西区一模)在一定条件下,物质A~E相互转化的关系如下图所示,其中A为单质,常温下E是无色液体.请根据条件回答下列问题(填写化学用语):(1)若A、C、D中均含有氯元素,其中氯的化合价由低到高的顺序为C、A、D.C为氯碱工业的原料,D的溶液有漂白性.则D的电子式为


Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
;(2)若B为短周期某种元素X的最高价氧化物的水化物.
①若A为亮红色固体,在加热条件下能与B的浓溶液反应,但不能与B的稀溶液反应,则元素x在周期表中的位置是
第三周期第ⅥA族
第三周期第ⅥA族
:若在常温下A与B的浓、稀溶液均能反应,则A与B的稀溶液反应的高于方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
.②若A为黑色固体,在加热条件下与B的浓溶液反应产生两种无色气体,则此反应的化学方程式是
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
(3)已知(1)中的B溶液电离出的阴离子M与(2)中的B溶液电离出的阳离子N都是10电子粒子,当100mL 0.5mol/L的M与100mL 0.55mol/LN完全反应生成E时放出akJ热量,该反应的热化学方程式为
H3O+(aq)+OH-(aq)=2H2O(l)△H=-20akJ/mol
H3O+(aq)+OH-(aq)=2H2O(l)△H=-20akJ/mol
.