摘要:氢氧化铝 (1)制取 Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4 Al3++3 NH3·H2O=Al(OH)3↓+3NH4+ 3的两性 Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+NaOH=NaAlO2+2H2O 3不稳定:2Al(OH)3 Al2O3+3H2O [例题] 例1.由锌.铁.铝.镁四种金属中的两种组成化合物10g.与足量的盐酸反应产生 的氢气在标况下为11.2L.则化合物中一定含有的金属是 A. 锌 B. 铁 C. 铝 D. 镁 解析:根据锌.铁.铝.镁四种金属与盐酸反应的方程式可知生成11.2L氢气需要各 金属的质量分别为:锌32.5g.铁28g.铝9g.镁12g.由此可得出化合物中一定含有铝. 答案选:C 例2.将分别盛有50mL1mol/L的硫酸的两个烧杯置于托盘天平的两盘上. 并调平.再向两杯中分别加入下列各组金属.反应完毕后.天平仍处于平衡的是 A.同是0.2mol钠和镁 B.同是1.5g铝和锌 C.同是1.5g铝和镁 D.同是1mol镁和铝 解析: 把选项分别代入.A.B.D两边增重不等.均被排除.所以C为答案. 例3.有镁.铝合金14.7g.全部溶于500mL6.0mol/L的盐酸中充分反应后.再加入400mL8.0mol/L的NaOH溶液.结果得到沉淀26.3g.则合金中镁.铝的质量分别为. A.13.5g和1.2g B.10.2g和4.5g C.1.2g和13.5g D.10.9g和3.8g 解析:镁和铝都能溶于盐酸.溶解后生成的镁盐和铝盐都能与NaOH反应.剩余的盐酸也能与NaOH反应.若NaOH过量还能将Al(OH)3溶解.反应的一系列离子方程式如下: Al+3H+=Al3++(3/2)H2↑ Al3++3OH-=Al(OH)3↓ Mg+2H+=Mg2++H2↑ Mg2++2OH-=Mg(OH)2↓ H++OH-=H2O 当NaOH过量时.还有: Al(OH)3+OH-=AlO2-+2H2O 讨论:若26.3g沉淀全都是Mg(OH)2.则镁的质量为26.3g/58×24=10.9g.铝的质量为14.7g-10.9g=3.8g, 若 26.3g沉淀为Mg(OH)2与Al(OH)3的混合物.则设合金中铝为x.镁为y.则: 27x+24y=14.7mol [x-mol]×78g/mol+58g/moly=2.63g 解之得:x=0.5mol y=0.05mol 合金中镁和铝的质量分别为:
网址:http://m.1010jiajiao.com/timu_id_3990941[举报]
[化学--选修2:化学与技术]
工业上通常采用碱法从铝土矿制取Al2O3,如图为碱法制取Al2O3的工艺流程.已知铝土矿中含有的杂质主要是氧化铁、含硅化合物.
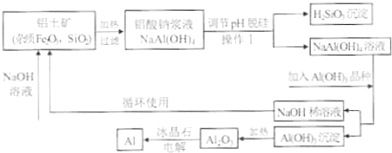
回答下列问题:
(1)操作I的名称是 ;得到的H2SiO3沉淀经过处理可得到硅胶,写出硅胶的一种用途 .
(2)工业上将Al2O3投入熔融的冰晶石,通过电解制备金属铝,冰晶石的作用是 .铝电解槽的阳极材料为碳块,需要定期更换,说明原因 .
(3)工业上用NaOH溶液溶解铝上矿,是利用了Al2O3的 性.
(4)写出铝土矿中杂质与加入的氢氧化钠溶液反应的离子方程式 .
(5)往铝酸钠[NaAl(OH)4]溶液中加入晶种Al(OH)3,通过结晶析出氢氧化铝,写出析出氢氧化铝的离子方程式 .
(6)氢氧化铝在不同温度下分解产物不同,已知:
2Al(OH)3
Al2O3?H2O+2H2O↑ Al2O3?H2O
Al2O3+H2O↑
现有一定温度下加热氢氧化铝得到的固体产物,经测定其中氢元素含量为1.0%,判断固体产物的成分是 .
查看习题详情和答案>>
工业上通常采用碱法从铝土矿制取Al2O3,如图为碱法制取Al2O3的工艺流程.已知铝土矿中含有的杂质主要是氧化铁、含硅化合物.

回答下列问题:
(1)操作I的名称是
(2)工业上将Al2O3投入熔融的冰晶石,通过电解制备金属铝,冰晶石的作用是
(3)工业上用NaOH溶液溶解铝上矿,是利用了Al2O3的
(4)写出铝土矿中杂质与加入的氢氧化钠溶液反应的离子方程式
(5)往铝酸钠[NaAl(OH)4]溶液中加入晶种Al(OH)3,通过结晶析出氢氧化铝,写出析出氢氧化铝的离子方程式
(6)氢氧化铝在不同温度下分解产物不同,已知:
2Al(OH)3
| ||
| ||
现有一定温度下加热氢氧化铝得到的固体产物,经测定其中氢元素含量为1.0%,判断固体产物的成分是
(2009?宿迁二模)实验化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4?7H2O).某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质.
(1)制备皓矾的实验流程如图所示.
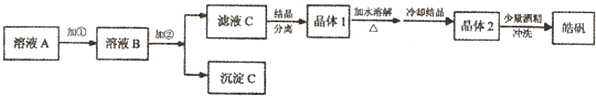
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7一3.7
Fe(OH)2:7.6一9.6
Zn(OH)2:5.7一8.0
试回答下列问题:①加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用
②加入的试剂②,供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用
③从晶体1→晶体2,该过程的名称是
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
(2)探究ZnSO4?7H2O的性质
⑤称取28.7g ZnSO4?7H2O研细后置于坩埚中小心加热,测得残留固体的质量与温度的对应数据见下表:
试写出ZnSO4?7H2O加热到1000℃时的反应方程式
⑥取少量ZnSO4?7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解;若改用氨水得到相同的现象.查资料知,氢氧化锌与氢氧化铝均有两性,且锌离子可与氨水形成络合离子[Zn(NH3)4]2+.则Zn(OH)2沉淀中加入NaOH溶液和加氨水均得到无色溶液的离子反应方程式为:
查看习题详情和答案>>
(1)制备皓矾的实验流程如图所示.

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7一3.7
Fe(OH)2:7.6一9.6
Zn(OH)2:5.7一8.0
试回答下列问题:①加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用
20%的H2O2
20%的H2O2
,其理由是将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质
将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质
②加入的试剂②,供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用
ZnO、Zn(OH)2、ZnCO3
ZnO、Zn(OH)2、ZnCO3
,其理由是调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质
调节溶液PH到3.7,使铁离子沉淀,同时不引入新的杂质
③从晶体1→晶体2,该过程的名称是
重结晶
重结晶
.④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率
为了冲洗掉晶体表面的杂质离子;防止晶体溶解,影响产率
.(2)探究ZnSO4?7H2O的性质
⑤称取28.7g ZnSO4?7H2O研细后置于坩埚中小心加热,测得残留固体的质量与温度的对应数据见下表:
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
ZnSO4?7H2O
ZnO+SO3+7H2O
| ||
ZnSO4?7H2O
ZnO+SO3+7H2O
.
| ||
⑥取少量ZnSO4?7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解;若改用氨水得到相同的现象.查资料知,氢氧化锌与氢氧化铝均有两性,且锌离子可与氨水形成络合离子[Zn(NH3)4]2+.则Zn(OH)2沉淀中加入NaOH溶液和加氨水均得到无色溶液的离子反应方程式为:
Zn(OH)2+2OH-=ZnO22-+2H2O
Zn(OH)2+2OH-=ZnO22-+2H2O
(任写一个).
阅读所给信息填写以下空白.
(1)人教版(必修1)教材中有如下实验:取两个相同的小木条,分别放入蒸馏水和Na2SiO3饱和溶液中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,同时分别放置在酒精灯外焰处.观察到的现象如下表:
请据此回答设计实验①的目的是 .
(2)最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你所学的氧化还原反应知识,用离子方程式表示产生氯气的原因: .
(3)已知向偏铝酸钠溶液中加入稀盐酸有氢氧化铝生成.某同学却根据所学知识,提出不能使用该方法制取A1(OH)3,理由为 (用简要的文字说明).请你另举出一种制取A1(OH)3的合理方法,该反应的离子方程式为 .
查看习题详情和答案>>
(1)人教版(必修1)教材中有如下实验:取两个相同的小木条,分别放入蒸馏水和Na2SiO3饱和溶液中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,同时分别放置在酒精灯外焰处.观察到的现象如下表:
| 编号 | 实验 | 现象 |
| ① | 放入蒸馏水 | 木条燃烧 |
| ② | 放入Na2SiO3饱和溶液 | 木条不燃烧 |
(2)最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你所学的氧化还原反应知识,用离子方程式表示产生氯气的原因:
(3)已知向偏铝酸钠溶液中加入稀盐酸有氢氧化铝生成.某同学却根据所学知识,提出不能使用该方法制取A1(OH)3,理由为

