摘要:氢氧化铝 (1)制取 3的两性 3不稳定: [投影]答案:]一.铝及重要化合物之间的转化关系
网址:http://m.1010jiajiao.com/timu_id_3990938[举报]
硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验.

已知:阳离子以氢氧化物形式完全沉淀时溶液的pH:
一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol?L-1.
请回答:
(1)写出A与氢氟酸反应的化学方程式: .
(2)上述流程中两次使用试剂X,推测试剂X是 (填以下字母编号)
A.水 B.氧化铝 C.氨水 D.氢氧化钠
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果
是 .(任写2点)
(4)写出F→H的反应离子方程式: .
(5)证明H溶液的主要阴离子(Cl-、OH-除外)的方法是 .
查看习题详情和答案>>

已知:阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 12.4 |
请回答:
(1)写出A与氢氟酸反应的化学方程式:
(2)上述流程中两次使用试剂X,推测试剂X是
A.水 B.氧化铝 C.氨水 D.氢氧化钠
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果
是
(4)写出F→H的反应离子方程式:
(5)证明H溶液的主要阴离子(Cl-、OH-除外)的方法是
某化学兴趣小组的同学在学习了《铝 金属材料》一节后,产生了浓厚的实验探究兴趣,欲对氢氧化铝的化学性质进行实验探究。请你帮助他们完成实验方案和记录并回答有关的问题。
实验目的
1.观察氢氧化铝与酸、碱的反应,认识氢氧化铝的特性。
2.提高实验能力,增强探究意识。
实验原理
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=[Al(OH)4]-
实验药品和仪器
1mol?L-1 Al2(SO4)3溶液、10%NaOH溶液、浓氨水、稀盐酸、试管、胶头滴管
实验探究
1.在一支盛有l mol?L-1Al2(SO4)3溶液的大试管中逐滴加入浓氨水,直到产生大量沉淀。
2.将上述沉淀分为三份盛在三个试管中,分别进行如下实验:
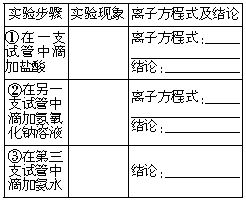
实验结论
1.通过实验探究,综合上述实验步骤①、②、③中的实验结论,你认为氢氧化铝具有___________,且氢氧化铝___________。
2.制取氢氧化铝时,用_________好。
讨论与思考
请你写出硫酸铝溶液与适量或过量氢氧化钠溶液反应时的化学方程式:______________________;________________________。
画出物质之间的物质的量的关系图:

拓展思考:查阅资料,试解释氢氧化铝为什么既能溶解在强酸溶液中,又能溶解在强碱溶液中,属于两性氢氧化物? 查看习题详情和答案>>
实验目的
1.观察氢氧化铝与酸、碱的反应,认识氢氧化铝的特性。
2.提高实验能力,增强探究意识。
实验原理
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=[Al(OH)4]-
实验药品和仪器
1mol?L-1 Al2(SO4)3溶液、10%NaOH溶液、浓氨水、稀盐酸、试管、胶头滴管
实验探究
1.在一支盛有l mol?L-1Al2(SO4)3溶液的大试管中逐滴加入浓氨水,直到产生大量沉淀。
2.将上述沉淀分为三份盛在三个试管中,分别进行如下实验:

实验结论
1.通过实验探究,综合上述实验步骤①、②、③中的实验结论,你认为氢氧化铝具有___________,且氢氧化铝___________。
2.制取氢氧化铝时,用_________好。
讨论与思考
请你写出硫酸铝溶液与适量或过量氢氧化钠溶液反应时的化学方程式:______________________;________________________。
画出物质之间的物质的量的关系图:

拓展思考:查阅资料,试解释氢氧化铝为什么既能溶解在强酸溶液中,又能溶解在强碱溶液中,属于两性氢氧化物? 查看习题详情和答案>>
(2011?枣庄模拟)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质.具体实验流程如下:

请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是
(2)由溶液3制取氢氧化铝的离子方程式为
(3)明矾石焙烧时产生SO2气体,请你写出能验证SO2气体具有还原性且实验现象明显的化学方程式
(4)请你写出验证溶液1中有NH4+的实验过程
(5)实验室用Fe2O3与CO反应来制取单质Fe.

①请你按气流由左到右方向连接下列各装置,顺序为:A→
②检验装置A气密性的方法是
③在点燃B处的酒精灯前,应进行的操作是
④装置C的作用是
查看习题详情和答案>>

请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是
漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
.(2)由溶液3制取氢氧化铝的离子方程式为
AlO2-+CO2+H2O=Al(OH)3+HCO3-
AlO2-+CO2+H2O=Al(OH)3+HCO3-
.(3)明矾石焙烧时产生SO2气体,请你写出能验证SO2气体具有还原性且实验现象明显的化学方程式
SO2+Cl2+2H2O=H2SO4+2HCl
SO2+Cl2+2H2O=H2SO4+2HCl
.(4)请你写出验证溶液1中有NH4+的实验过程
取少量溶液1于试管中,加入浓氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,证明溶液1中含有NH4+
取少量溶液1于试管中,加入浓氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,证明溶液1中含有NH4+
.(5)实验室用Fe2O3与CO反应来制取单质Fe.

①请你按气流由左到右方向连接下列各装置,顺序为:A→
E→B→C→D
E→B→C→D
.②检验装置A气密性的方法是
关闭a、b两处活塞,将导气管插入水槽中,微热,导气管口有气泡产生,停止微热,一段时间后,导管中形成一段水柱,说明气密性良好
关闭a、b两处活塞,将导气管插入水槽中,微热,导气管口有气泡产生,停止微热,一段时间后,导管中形成一段水柱,说明气密性良好
.③在点燃B处的酒精灯前,应进行的操作是
检验CO气体纯度
检验CO气体纯度
.④装置C的作用是
除去CO气体混有的二氧化碳,利用CO点燃
除去CO气体混有的二氧化碳,利用CO点燃
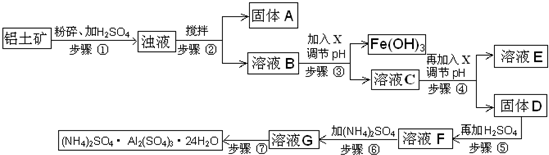
.(2012?顺义区二模)硫酸铝铵常用于水的净化以及工业水的处理.硫酸铝铵是白色透明结晶硬块,易溶于热水,水溶液呈酸性;随温度升高、脱去结晶水,产生晶变.工业用铝土矿(主要成分Al2O3、少量SiO2、Fe2O3、MgO等)为原料制取硫酸铝铵的工艺流程示意图如下:
部分氢氧化物沉淀的pH如下表:
请回答下列问题:
(1)步骤③中调节pH使Fe(OH)3沉淀完全,检验Fe3+是否沉淀完全的操作是
(2)若X为NaOH,步骤④中发生反应的离子方程式是
(3)用化学平衡移动原理解释步骤⑤中加入硫酸的作用
(4)硫酸铝铵水溶液呈酸性的原因是
(5)步骤⑥中,要求温度控制在90-100℃之间至硫酸铵全部溶解,其原因是
(6)步骤⑦的操作方法包括
查看习题详情和答案>>

部分氢氧化物沉淀的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 3.8 | 2.7 | 9.4 |
| 完全沉淀pH | 5.2 | 3.2 | 12.4 |
(1)步骤③中调节pH使Fe(OH)3沉淀完全,检验Fe3+是否沉淀完全的操作是
取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;若溶液不变色,说明Fe3+已沉淀完全
取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;若溶液不变色,说明Fe3+已沉淀完全
.(2)若X为NaOH,步骤④中发生反应的离子方程式是
Al3+﹢3OH-=Al(OH)3↓
Al3+﹢3OH-=Al(OH)3↓
.(3)用化学平衡移动原理解释步骤⑤中加入硫酸的作用
硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解
硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解
.(4)硫酸铝铵水溶液呈酸性的原因是
Al3+﹢3H2O?Al (OH)3﹢3H+、NH4++H2O?NH3?H2O+H+
Al3+﹢3H2O?Al (OH)3﹢3H+、NH4++H2O?NH3?H2O+H+
(用离子方程式表示).浓度均为0.1mol/L硫酸铝和硫酸铝铵两种水溶液,c(Al3+) 较大的是硫酸铝铵
硫酸铝铵
(填“硫酸铝铵”或“硫酸铝”)溶液.(5)步骤⑥中,要求温度控制在90-100℃之间至硫酸铵全部溶解,其原因是
因为硫酸铝铵易溶于热水,有利于生成;随温度升高、脱去结晶水,产生晶变.所以
温度控制在90-100℃之间
温度控制在90-100℃之间
因为硫酸铝铵易溶于热水,有利于生成;随温度升高、脱去结晶水,产生晶变.所以
温度控制在90-100℃之间
.温度控制在90-100℃之间
(6)步骤⑦的操作方法包括
冷却,结晶、过滤、洗涤、干燥
冷却,结晶、过滤、洗涤、干燥
.