网址:http://m.1010jiajiao.com/timu_id_3988223[举报]
(1)需准确量取98%的硫酸
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol?L-1的硫酸溶液480mL,必须用到的实验仪器是(填写序号):
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平
⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒 ⑨酸式滴定管
(3)若配制3.68mol?L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒.
B.烧杯内的稀硫酸未冷却至室温就转移至容量瓶中
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切.
D.用胶头滴管加水时,视线高于刻线读数
Ⅱ.实验室用燃料法测定某种氨基酸(CxHyOzNp)的分子式组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.现用如图所示装置置进行实验(铁架台、铁夹、酒精灯等未画出).请回答有关问题:
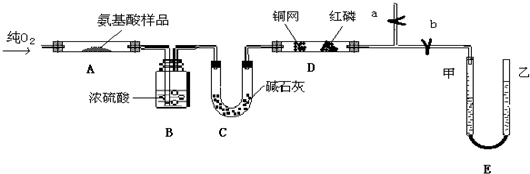
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的氧气,这样做的目的是
(2)由装置B、C可分别确定待测氨基酸中含有的
(3)E装置的作用是测量
a、视线与凹液面最低处相平
b、等待片刻,待乙管中液面不再上升时,立刻读数
c、读数时应上下移动乙管,使甲、乙两管液面相平
d、读数时不一定使甲、乙两管液面相平
(4)实验中测定的哪一数据可能不准确
(5)严格地说,按上述方案只能确定氨基酸的
(12分)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中趁热过滤,其原因是________________________________;
(3)在步骤3制的的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,有关的离子方程式是_________________________ _____。
(4)制得的晶体经过过滤后用无水乙醇洗涤而不用蒸馏水,理由是__________________;(任说两点)
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子浓度由小到大的排列顺序为_______________(用a、b、c回答)
(12分)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中趁热过滤,其原因是________________________________;
(3)在步骤3制的的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,有关的离子方程式是_________________________ _____。
(4)制得的晶体经过过滤后用无水乙醇洗涤而不用蒸馏水,理由是__________________;(任说两点)
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子浓度由小到大的排列顺序为_______________(用a、b、c回答)
查看习题详情和答案>>
Ⅰ.实验室要用98%(ρ=1.84g?cm-3)的硫酸配制3.68mol?L-1的硫酸溶液480mL
(1)需准确量取98%的硫酸______mL.
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol?L-1的硫酸溶液480mL,必须用到的实验仪器是(填写序号):______.
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平
⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒 ⑨酸式滴定管
(3)若配制3.68mol?L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是______.
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒.
B.烧杯内的稀硫酸未冷却至室温就转移至容量瓶中
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切.
D.用胶头滴管加水时,视线高于刻线读数
Ⅱ.实验室用燃料法测定某种氨基酸(CxHyOzNp)的分子式组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.现用如图所示装置置进行实验(铁架台、铁夹、酒精灯等未画出).请回答有关问题:
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的氧气,这样做的目的是______,之后关闭止水夹a.
(2)由装置B、C可分别确定待测氨基酸中含有的______和______质量.
(3)E装置的作用是测量______的体积,并由此确定待测氨基酸中含有的______的质量,为了较准确地测量该气体的体积.在读反应前后甲管中液面的读数求其差值的过程中,应注意______(填代号).
a、视线与凹液面最低处相平
b、等待片刻,待乙管中液面不再上升时,立刻读数
c、读数时应上下移动乙管,使甲、乙两管液面相平
d、读数时不一定使甲、乙两管液面相平
(4)实验中测定的哪一数据可能不准确______其理由是______
(5)严格地说,按上述方案只能确定氨基酸的______.若要确定此氨基酸的分子式,还要测定该氨基酸的______.
查看习题详情和答案>>
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2 向处理过的铁屑中加入过量的3 mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号)
①铁架台
②燃烧匙
③锥形瓶
④广口瓶
⑤研钵
⑥玻璃棒
⑦酒精灯
(2)在步骤2中趁热过滤,其原因是________;
(3)在步骤3制的的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+的试剂可以用K4[Fe(CN)6]生成普鲁士蓝沉淀,有关的离子方程式是________.
(4)制得的晶体经过过滤后用无水乙醇洗涤而不用蒸馏水,理由是________;(任说两点)
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子浓度由小到大的排列顺序为________(用a、b、c回答)