摘要:答案:4NH3+6NO5N2+6H2O 解析:由题意NO中+2价氮作氧化剂.NH3中-3价的氮作还原剂.NON2.但NH3的氧化产物没给.因该反应属同种元素间的氧化还原反应.所以-3价氮的氧化产物的化合价应介于-3和0之间(氧化产物价态不能高于还原产物的价态).所以NH3N2.如此反应物.生成物都已确定.即可写出该反应方程式.(同时要注意提高配平技能)
网址:http://m.1010jiajiao.com/timu_id_3987378[举报]
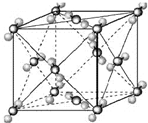 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.试回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.(2)A、B、C的第一电离能由大到小的顺序为
N>C>Si
N>C>Si
.(3)B元素的单质分子中有
2
2
个π键,与其互为等电子体的物质的化学式可能为CO(或其他合理答案)
CO(或其他合理答案)
(任写一种).(4)上述A的氧化物分子的中心原子采取
sp
sp
杂化,其晶胞中微粒间的作用力为范德华力
范德华力
.(5)EH3分子的空间构型为
三角锥形
三角锥形
,其沸点与BH3相比低
低
(填“高”或“低”),原因是NH3分子间能形成氢键,AsH3分子间不能形成氢键
NH3分子间能形成氢键,AsH3分子间不能形成氢键
.(6)向CuSO4溶液中逐滴加入BH3的水溶液,得到深蓝色的透明溶液.请写出该反应的离子方程式
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
Cu2++2NH3?H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
.(2011?上海)氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水.由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量.
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+4NH3=5N2+6H2O
6NO2+8NH3=7N2+12H2O
NO与NO2混合气体180mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气.吸收后氨水密度为0.980g/cm3.
计算:①该混合气体中NO与NO2的体积比.
②吸收后氨水的物质的量浓度(答案保留1位小数).
(4)氨和二氧化碳反应可生成尿素CO(NH2)2.尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
已知常压下120mol CO(NH2)2在熔融状态发生缩合反应,失去80mol NH3,生成二聚物(C2H5N3O2)和三聚物.测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比.
查看习题详情和答案>>
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式
HN3
HN3
.该氢化物受撞击则完全分解为氮气和氢气.4.30g该氢化物受撞击后产生的气体在标准状况下的体积为4.48
4.48
L.(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水.由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量.
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+4NH3=5N2+6H2O
6NO2+8NH3=7N2+12H2O
NO与NO2混合气体180mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气.吸收后氨水密度为0.980g/cm3.
计算:①该混合气体中NO与NO2的体积比.
②吸收后氨水的物质的量浓度(答案保留1位小数).
(4)氨和二氧化碳反应可生成尿素CO(NH2)2.尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:

已知常压下120mol CO(NH2)2在熔融状态发生缩合反应,失去80mol NH3,生成二聚物(C2H5N3O2)和三聚物.测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比.
下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.
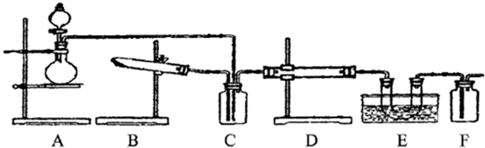
I.甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学方程式是
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察
(3)本实验在设计上有无缺失之处?若有请答出改进方案
II.乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式
(5)对于A处,乙认为没有加热装置,请代乙阐述A中气体的产生原理
查看习题详情和答案>>

I.甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学方程式是
Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑
Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑
,C装置中盛放的液体药品的名称是浓硫酸
浓硫酸
.(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察
C中两导管口气泡的产生速率
C中两导管口气泡的产生速率
得知.(3)本实验在设计上有无缺失之处?若有请答出改进方案
有,应在EF之间连接一个防倒吸装置
有,应在EF之间连接一个防倒吸装置
;(若无,此问可不答)II.乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式
4NH3+5O2
4NO+6H2O(若多写2NO+O2=2NO2也可以)
| ||
4NH3+5O2
4NO+6H2O(若多写2NO+O2=2NO2也可以)
.
| ||
(5)对于A处,乙认为没有加热装置,请代乙阐述A中气体的产生原理
将分液漏斗中的浓氨水滴加至圆底烧瓶中的固体NaOH(或生石灰或碱石灰)中,反应放热溶液中c(OH-)增大氨水浓度增大,上述三个因素均导致氨水中的平衡:NH3+H2O?NH3?H2O?NH4++OH-向左移动致使NH3逸出
将分液漏斗中的浓氨水滴加至圆底烧瓶中的固体NaOH(或生石灰或碱石灰)中,反应放热溶液中c(OH-)增大氨水浓度增大,上述三个因素均导致氨水中的平衡:NH3+H2O?NH3?H2O?NH4++OH-向左移动致使NH3逸出
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基 本一致,那么C处的广口瓶应改为U形管或干燥管
U形管或干燥管
,所装药品为碱石灰(其他合理答案亦可)
碱石灰(其他合理答案亦可)
.
我国“神舟九号”航天飞船成功发射升空,表明我国的载人航天技术又有了新的进展.在运送飞船的某些火箭推进器中盛有燃料液态肼(N2H4)和氧化剂.
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式 .该氢化物受撞击则完全分解为氮气和氢气.4.30g该氢化物受撞击后产生的气体在标准状况下的体积为 L.
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水.由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量 .
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为:6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O.NO与NO2混合气体180mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气,吸收后氨水密度为0.980g/cm3.
计算:①该混合气体中NO与NO2的体积比 .
②吸收后氨水的物质的量浓度(答案保留1位小数) .
查看习题详情和答案>>
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水.由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为:6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O.NO与NO2混合气体180mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气,吸收后氨水密度为0.980g/cm3.
计算:①该混合气体中NO与NO2的体积比
②吸收后氨水的物质的量浓度(答案保留1位小数)
 具有如图转化关系的物质A、B、C有多种组合,请你根据下列要求回答问题.(如果有多组答案符合题意的,写出其中一种即可.)
具有如图转化关系的物质A、B、C有多种组合,请你根据下列要求回答问题.(如果有多组答案符合题意的,写出其中一种即可.)(1)若A是固态非金属单质,B是形成酸雨的物质,则C的分子式是
SO3
SO3
.(2)若A是能使湿润红色石蕊试纸变蓝色的气体,符合要求的A→B的化学反应方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)若A是强碱溶液,符合要求的B→C的离子反应方程式为
Al3++3AlO2-+6H2O═4Al(OH)3↓
Al3++3AlO2-+6H2O═4Al(OH)3↓
.(4)若A是能使湿润淀粉碘化钾试纸变蓝色的气态非金属单质,符合要求的B→C的离子反应方程式为
2Fe3++Fe═3Fe2+
2Fe3++Fe═3Fe2+
.