摘要:答案:BC 解析:可用极值法解此题.如果仅被还原为+4的氮.所得混合物的平均式量最大.为:=55.2 g·mol-1,如稀硝酸只被还原为NO.则其式量为30.实质为NO.NO2.N2O4的混合气体.所以其式量介于55.2和30之间.
网址:http://m.1010jiajiao.com/timu_id_3987347[举报]
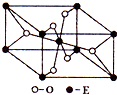 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为
(2)下列叙述正确的是
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为
(4)电镀厂排放的废水中常含有剧毒的BC-离子,可在Q的催化下,先用NaClO将BC-氧化成BCD-,再在酸性条件下BCD-继续被NaClO氧化成C2和BD2.
①A、B、C、D四种元素的电负性由小到大的顺序为
②与BCD-互为等电子体的分子、离子的化学式依次为
③上述反应中后一步反应的离子方程式是
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为
 如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:
如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:(1)B、D形成的化合物甲,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为
原子晶体
原子晶体
;乙的化学式为Si3N4
Si3N4
.(2)B、D分别可与E形成化合物丙、丁,丙属于
非极性
非极性
(填“非极性”或“极性”)分子,试将甲、乙、丙、丁四种物质按熔点由高到低的顺序排列:Si3N4>SiC>SiCl4>CCl4
Si3N4>SiC>SiCl4>CCl4
.(用化学式表示)(3)B和C元素形成的物质(BC)2可称为拟卤素,写出该物质与NaOH溶液反应的离子方程式
(CN)2+2OH-=CN-+CNO-+H2O
(CN)2+2OH-=CN-+CNO-+H2O
.(4)C、E形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体、C的最高价含氧酸及E的氢化物,写出该反应的化学方程式
3NCl3+5H2O=2NO+HNO3+9HCl
3NCl3+5H2O=2NO+HNO3+9HCl
.下列说法正确的是( )
A.因为p轨道是“8”字形的,所以p电子走“8”字形
B.第三电子层,有3s、3p、3d三个轨道(答案只选D,可B应该是正确的)
C.铝元素原子核外共有5种不同运动状态的电子
D.电离能最小的电子能量最高
查看习题详情和答案>>
下列说法正确的是( )
| A.因为p轨道是“8”字形的,所以p电子走“8”字形 |
| B.第三电子层,有3s、3p、3d三个轨道(答案只选D,可B应该是正确的) |
| C.铝元素原子核外共有5种不同运动状态的电子 |
| D.电离能最小的电子能量最高 |
如图为元素周期表中的一部分,A、B、C、D、E均为短周期主族元素,B元素原子的最外层有4个电子,E原子最外层电子数与C的原子序数相等.回答下列问题:
(1)B、D形成的化合物甲,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为______;乙的化学式为______.
(2)B、D分别可与E形成化合物丙、丁,丙属于______ (填“非极性”或“极性”)分子,试将甲、乙、丙、丁四种物质按熔点由高到低的顺序排列:______.(用化学式表示)
(3)B和C元素形成的物质(BC)2可称为拟卤素,写出该物质与NaOH溶液反应的离子方程式______.
(4)C、E形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体、C的最高价含氧酸及E的氢化物,写出该反应的化学方程式______.
查看习题详情和答案>>
(1)B、D形成的化合物甲,C、D形成的化合物乙,二者晶体结构均为空间网状结构,则其晶体类型为______;乙的化学式为______.
(2)B、D分别可与E形成化合物丙、丁,丙属于______ (填“非极性”或“极性”)分子,试将甲、乙、丙、丁四种物质按熔点由高到低的顺序排列:______.(用化学式表示)
(3)B和C元素形成的物质(BC)2可称为拟卤素,写出该物质与NaOH溶液反应的离子方程式______.
(4)C、E形成的分子的空间构型为三角锥形,分子中各原子最外层均达8电子稳定结构,该物质在潮湿的空气中与水蒸气能发生氧化还原反应,生成含C的无色氧化物气体、C的最高价含氧酸及E的氢化物,写出该反应的化学方程式______.
