摘要:595.在2Na 2O2+ 2CO2 = 2Na 2CO3 +O2↑反应中.有关说法正确的是( ) A. Na 2O2是 氧化剂.CO2 是还原剂 B. CO2是 氧化剂.Na 2O2是还原剂 C. Na 2O2 既是氧化剂又是还原剂 D.电子转移总数是4 e-
网址:http://m.1010jiajiao.com/timu_id_3986842[举报]
 化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
化学反应在工农业生产中有着重要的应用.按要求回答下列问题:(1)利用化学反应可以制备许多物质.
①实验室用铜制备NO的离子方程式为
②可用Al和Fe2O3制Fe,该反应的化学方程式为
③海水提溴过程中,向浓缩的海水中通入氯气,再用热空气吹出生成的溴,然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-.这两步反应的离子方程式分别为
(2)化学反应能为人类生产生活提供能源.
①由反应CH4+2O2
| ||
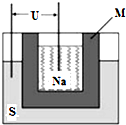
②2011年山东高考化学中曾提到钠硫高能电池,如图是该电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx.该电池负极为
(2013?和平区二模)有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D元素在周期表中的位置为
(2)可以比较D和F得电子能力强弱的是
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有
 .
.
(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.
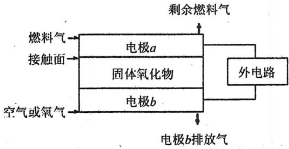
①固体氧化物中的O2-向
②电极b为电池
③若A2作为燃料气,则接触面上发生的反应为
④若B2A4作为燃料气,则接触面上发生的反应为
查看习题详情和答案>>
(1)D元素在周期表中的位置为
第二周期第VIA族
第二周期第VIA族
.(2)可以比较D和F得电子能力强弱的是
bc
bc
(填写编号).a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有
离子键、共价键
离子键、共价键
;并写出其中阳离子的电子式

(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol
.(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.

①固体氧化物中的O2-向
负
负
(填“正”或“负”)极移动.②电极b为电池
正
正
极,其电极反应式为O2+4e-=2O2-
O2+4e-=2O2-
.③若A2作为燃料气,则接触面上发生的反应为
H2+O2--2e-=H2O
H2+O2--2e-=H2O
.④若B2A4作为燃料气,则接触面上发生的反应为
C2H4+6O2--12e-=2CO2+2H2O
C2H4+6O2--12e-=2CO2+2H2O
.完成下列电离方程式、化学方程式的书写.
(1)碳酸钠在水中电离
(2)红热的细铁丝伸入氧气瓶中
(3)工业上用CO冶炼氧化铁
(4)检验KCl溶液中的氯离子
(5)NaOH与氯化铵溶液混合加热
上述反应中属于氧化还原反应的有
查看习题详情和答案>>
(1)碳酸钠在水中电离
Na2CO3=2Na++CO32-
Na2CO3=2Na++CO32-
.(2)红热的细铁丝伸入氧气瓶中
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.
| ||
(3)工业上用CO冶炼氧化铁
3CO+Fe2O3
3CO2+2Fe
| ||
3CO+Fe2O3
3CO2+2Fe
.
| ||
(4)检验KCl溶液中的氯离子
取少许溶液加入硝酸酸化的硝酸银溶液,出现白色沉淀证明含有氯离子
取少许溶液加入硝酸酸化的硝酸银溶液,出现白色沉淀证明含有氯离子
.(5)NaOH与氯化铵溶液混合加热
NH4Cl+NaOH
NH3↑+H2O+NaCl
| ||
NH4Cl+NaOH
NH3↑+H2O+NaCl
.
| ||
上述反应中属于氧化还原反应的有
(2)(3)
(2)(3)
填序号). 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.
利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径.(1)已知:CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)△H=-890.3kJ?mol-1 ①
H2(g)+1/2O2 (g)=H2O (l)△H=-285.8kJ?mol-1 ②
CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ?mol-1 ③
H2O(g)=H2O(l)△H=-44.0kJ?mol-1 ④
反应CH4(g)+H2O(g)
| ||
+206.1
+206.1
kJ?mol-1.标准状况下33.6L甲烷高温下与水蒸气完全反应生成CO和H2,反应过程中转移9
9
mole-,放出309.15
309.15
kJ热量.(2)一定条件下,在体积为5L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).不同温度时甲烷的物质的量随时间变化曲线如图所示.根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
增大
增大
(填“增大”、“减小”或“不变”).②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
2nA/5tAmol?(L?min)-1
2nA/5tAmol?(L?min)-1
.(用相关符号和数据表示)③判断该可逆反应达到平衡状态的标志是
bd
bd
.(填字母)a.CH3OH的生成速率与CO的消耗速率相等 b.容器中气体的压强不变
c.容器中混合气体的密度保持不变 d.CO百分含量保持不变
e.CO和CH3OH浓度相等
④欲提高H2的转化率,下列措施可行的是
c
c
.(填字母)a.向容器中再充入Ar b.改变反应的催化剂
c.向容器中再充入CO d.升高温度.
 A、B、C、D、E五种短周期元素,原子序数依次递增.A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,E与C是同主族元素.C、D两种元素可形成化合物甲,甲中既有离子键又有共价键;A、B、C、D四种元素可形成化合物乙,乙放入水中所得溶液显碱性.请回答:
A、B、C、D、E五种短周期元素,原子序数依次递增.A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,E与C是同主族元素.C、D两种元素可形成化合物甲,甲中既有离子键又有共价键;A、B、C、D四种元素可形成化合物乙,乙放入水中所得溶液显碱性.请回答:(1)化合物甲的电子式为
Na+[ ]2-Na+
]2-Na+
 ]2-Na+
]2-Na+Na+[ ]2-Na+
]2-Na+
;乙的化学式有很多种,其中无机物是 ]2-Na+
]2-Na+NaHCO3
NaHCO3
,相对分子质量最小的有机物是CH3ONa
CH3ONa
.(2)气体A2、C2和A、C、D形成的离子化合物的水溶液可形成燃料电池,其正极的电极反应式为
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
,电池总反应得到1.8g产物时,流经外电路某一横截面的电子数为1.204×1023(或0.2NA)
1.204×1023(或0.2NA)
.(3)A、B能形成无数种化合物,其中密度最小的气态化合物燃烧热为890.3 kJ/mol,该化合物燃烧的热化学方程式为
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
.(4)都由A、C、D、E形成的两种化合物可以相互反应,其离子方程式为
H++HSO3-═SO2↑+H2O
H++HSO3-═SO2↑+H2O
.