网址:http://m.1010jiajiao.com/timu_id_3982729[举报]
下表是元素周期表的一部分.
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外电子层中L层电子数比K层电子数多3,则该元素的元素符号是 ,其单质的电子式为 .
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
;
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
(4)元素⑤的氢化物是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
①合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A.采用较高压强(20Mpa~50Mpa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
②上图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法 。
③在298K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924kJ?
。
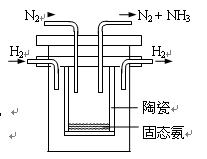
④1998年希腊亚里斯多德大学的Marmellos和Stoukides发明一种合成氨的新方法。在常压下,将H2与用He稀释的N2分别通入一加热到570℃的,以锶-铈-钇-钙钛矿多孔陶瓷(SCY)为固体电解质的电解池中转化为氨气(SCY陶瓷能传递H+),H2转化率达到78%。其实验装置如图所示。阴极的电极反应式 。
查看习题详情和答案>>
下表是元素周期表的一部分.

(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外电子层中L层电子数比K层电子数多3,则该元素的元素符号是 ,其单质的电子式为 .
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
;
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
(4)元素⑤的氢化物是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
①合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A.采用较高压强(20Mpa~50Mpa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2

②上图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法 。
③在298K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924kJ?
。
④1998年希腊亚里斯多德大学的Marmellos和Stoukides发明一种合成氨的新方法。在常压下,将H2与用He稀释的N2分别通入一加热到570℃的,以锶-铈-钇-钙钛矿多孔陶瓷(SCY)为固体电解质的电解池中转化为氨气(SCY陶瓷能传递H+),H2转化率达到78%。其实验装置如图所示。阴极的电极反应式 。

查看习题详情和答案>>
下表是元素周期表的一部分.
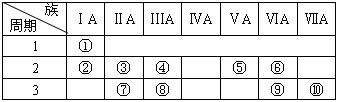
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外电子层中L层电子数比K层电子数多3,则该元素的元素符号是 ,其单质的电子式为 .
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
;
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
(4)元素⑤的氢化物是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
①合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A.采用较高压强(20Mpa~50Mpa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
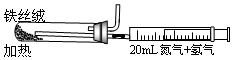
②上图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法 。
③在298K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924kJ?
。
④1998年希腊亚里斯多德大学的Marmellos和Stoukides发明一种合成氨的新方法。在常压下,将H2与用He稀释的N2分别通入一加热到570℃的,以锶-铈-钇-钙钛矿多孔陶瓷(SCY)为固体电解质的电解池中转化为氨气(SCY陶瓷能传递H+),H2转化率达到78%。其实验装置如图所示。阴极的电极反应式 。
Al2O3+3C+N2
| 高温 |
(问题探究)某化学研究性学习小组成员根据氮化铝的制取原理,进行了如下探究.
问题1、在制取氮化铝时由于反应不完全,氮化铝产品中所含杂质除了碳以外还可能存在______.
问题2、为测定该产品中有关成分的含量,甲、乙两同学设计了以下两个实验:
(1)甲同学:称取10.00g样品,将其加入过量的氢氧化钠溶液中共热并蒸干,AlN跟氢氧化钠溶液反应生成NaAlO2,并放出氨气3.36L(标准状况).
①上述反应的化学方程式为______.
②该样品中的AlN的质量分数为______.
(2)乙同学:称取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g?L-1(已折成标准状况,AlN不跟O2反应).该样品中含杂质碳______g.
问题3、丙同学受到甲、乙同学实验的启发,认为测定某氮化铝中含有碳或氧化铝杂质,可用图中I的一些装置来进行检验,根据AlN与NaOH溶液反应所生成氨气的体积来测定样品中氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)
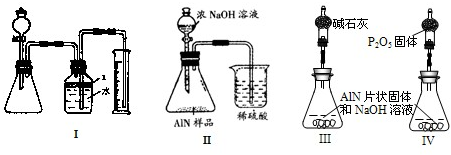
(1)实验有关操作为:①往锥形瓶中放入适量的AlN样品:②从分液漏斗往锥形瓶中加入过量的浓NaOH;③检验装置的气密性;④测定收集到水的体积.
正确的操作顺序为______.
(2)本试验中检查装置气密性的方法是______.
(3)广口瓶中的试剂X可最好选用______(填选项的标号).
A、苯 B、酒精 C、植物油 D、CCl4
(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将______(填偏大、偏小或不变).
(5)若实验中测得样品的质量为wg,氨气的体积为aL(标况下),则样品中AlN的质量分数为______(AlN的式量为41).
(6)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是______,为了测定是否含有其它杂质,则还需要哪些简单数据______.
问题4、丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大.建议改用图9中的Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数.你认为是否可行?______(填入“可行”、“不可行”),原因是______.最简单的改进方法为______.
问题5、戊同学仔细思考了丁同学的装置后,认为此装置所测测得的样品中AlN含量偏小.其原因是______.若忽略此原因的话,只要用图9中的III或IV两个装置中的一种,只需进行简单而又必要的数据测定,可比较准确地确定样品中AlN的质量分数.较合理的装置为______(填代号).你认为戊同学的装置是否还有缺陷?______.若有,所测结果将偏高或偏低______,应作如何改进?______.(若无缺陷后两此格可不填).
下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:
族 周期 | IA |
| 0 | |||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 |
|
|
| ② | ③ | ④ |
|
|
3 | ⑤ |
| ⑥ | ⑦ |
|
| ⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为(元素符号)________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________????? 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:_______________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:_______。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为???????????????????? 。
(6)若用①②组成最简单的有机物作为燃料电池的原料,请写出在碱性介质中燃料电池负极的电极反应式:?????????????????????????????????????????????????? ?????? 。
(7)燃煤废气中的含有氮氧化物(NOx)、二氧化碳等气体,常用下列方法对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物。
如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) , △H =-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)? , △H =-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为??????????????????????????? ? 。
查看习题详情和答案>>