摘要:1.复习回忆 1).催化剂为什么能够加快反应速度? 2).什么是有效碰撞.活化分子.活化能? 3).化学反应中能量变化的主要原因? 4).你了解“即热饭盒吗?知道是什么原理吗? 5).什么是反应热
网址:http://m.1010jiajiao.com/timu_id_3982027[举报]
 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
(1)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
-246.1KJ/mol
-246.1KJ/mol
.(2)在温度和容积不变的条件下发生反应①,能说明该反应达到化学平衡状态的依据是
ab
ab
(多选扣分).a.容器中压强保持不变;b.混合气体中c(CO)不变;c.v正(CO)=v逆(H2);d.c(CH3OH)=c(CO)
(3)在2L的容器中加入amolCH3OH(g)发生反应②,达到平衡后若再加入amolCH3OH(g)重新达到平衡时,CH3OH的转化率
不变
不变
(填“增大”、“减小”或“不变”).(4)850℃时在一体积为10L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示.
①0~4min的平均反应速率υ(CO)=
0.03mol/L?min
0.03mol/L?min
.②若温度不变,向该容器中加入4molCO、2molH2O、3molCO2(g)和3molH2(g),起始时D正
<
<
V逆(填“<”、“>”或“=”),请结合必要的计算说明理由Qc=
=
,K=
=1,因为Qc>K,平衡左移,V正<V逆
| 0.3,mol/L×0,3mol/L |
| 0.4mol/L×0.2mol/L |
| 9 |
| 8 |
| 0.12mol/L×0.12mol/L |
| 0.08mol/L×0.18mol/L |
Qc=
=
,K=
=1,因为Qc>K,平衡左移,V正<V逆
.| 0.3,mol/L×0,3mol/L |
| 0.4mol/L×0.2mol/L |
| 9 |
| 8 |
| 0.12mol/L×0.12mol/L |
| 0.08mol/L×0.18mol/L |
硫酸工业流程如下所示:

(1)催化反应室发生反应的化学方程式是:
该反应通常用V2O5作催化剂,其催化机理可能是:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被O2氧化.写出该催化循环机理的化学方程式:
(2)依据流程图判断下列说法正确的是
a.过量空气能提高SO2的转化率
b.使用催化剂能提高SO2的反应速率和转化率
c.用98%的硫酸吸收SO3,可以避免形成酸雾并提高吸收率
(3)每160g SO3气体与H2O(l)化合放出260.6kJ的热量,该反应的热化学方程式是
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理.这样做除了防止SO2污染环境并得到铵盐外,主要目的是:
查看习题详情和答案>>

(1)催化反应室发生反应的化学方程式是:
2SO2(g)+O2(g)
2SO3(g)
| ||
| △ |
2SO2(g)+O2(g)
2SO3(g)
.
| ||
| △ |
该反应通常用V2O5作催化剂,其催化机理可能是:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被O2氧化.写出该催化循环机理的化学方程式:
SO2+V2O5=SO3+2VO2、O2+4VO2=2V2O5
SO2+V2O5=SO3+2VO2、O2+4VO2=2V2O5
.(2)依据流程图判断下列说法正确的是
ac
ac
(填字母).a.过量空气能提高SO2的转化率
b.使用催化剂能提高SO2的反应速率和转化率
c.用98%的硫酸吸收SO3,可以避免形成酸雾并提高吸收率
(3)每160g SO3气体与H2O(l)化合放出260.6kJ的热量,该反应的热化学方程式是
SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol
SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ/mol
.(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理.这样做除了防止SO2污染环境并得到铵盐外,主要目的是:
得到较高浓度的SO2,原料循环再利用
得到较高浓度的SO2,原料循环再利用
.(2013?重庆)化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
(1)催化反硝化法中,H2能将NO3-还原为N2.25℃时,反应进行10min,溶液的pH由7变为12.
①N2的结构式为
②上述反应的离子方程式为,其平均反应速率υ(NO3-)为
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法
(2)电化学降解NO3-的原理如图所示.
①电源正极为
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为
查看习题详情和答案>>

(1)催化反硝化法中,H2能将NO3-还原为N2.25℃时,反应进行10min,溶液的pH由7变为12.
①N2的结构式为
N≡N
N≡N
.②上述反应的离子方程式为,其平均反应速率υ(NO3-)为
0.001
0.001
mol?L-1?min-1.③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法
加水、升高温度、加酸
加水、升高温度、加酸
.(2)电化学降解NO3-的原理如图所示.
①电源正极为
A
A
(填A或B),阴极反应式为2NO3-+12H++10e-=N2+6H2O
2NO3-+12H++10e-=N2+6H2O
.②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为
14.4
14.4
g.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,由乙醇制取氢气 具有良好的应用前景.已知由乙醇制取氢气可有如下两条路线:
①水蒸气催化重整:CH3CH2OH(g)+H2O(g)═4H2(g)+2CO(g)△H=+255.58kJ?mol-1
②部分催化氧化:CH3CH2OH(g)+
O2(g)═3H2(g)+2CO(g)△H=+13.76kJ?mol-1
请回答下列问题:
(1)下列说法正确的是 .(填字母)
A.从原料消耗的角度来看,路线①制氢更有价值
B.从能量消耗的角度来看,路线①制氢更加有利
C.由于路线②制氢要消耗很多能量,故在实际生产中意义不大
D.路线①和路线②均使用催化剂,是为了降低反应所需的能量
(2)在体积为1L的密闭容器中充入2mol CO和4mol H2,一定条件下发生反应:
4H2(g)+2CO(g)?CH3CH2OH(g)+H2O(g)△H=-255.58kJ?mol-1
欲使n(CH3CH2OH)/n(CO)增大,应采取措施是 .(答两项即可)
(3)若用0.81t淀粉为原料,理论上可制得质量分数为92%的乙醇溶液 t.
(4)若用乙醇得到的合成气(CO、H2的混合气)来合成一种生物汽油.乙醇按路线①和路线②的反应各占50%,合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O
假定这种生物汽油中含有X、Y两种成分,且X、Y都是含8个碳原子的烃,X是苯的同系物,Y是烷烃.1t质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),最终可得到X的质量为多少吨? .
查看习题详情和答案>>
①水蒸气催化重整:CH3CH2OH(g)+H2O(g)═4H2(g)+2CO(g)△H=+255.58kJ?mol-1
②部分催化氧化:CH3CH2OH(g)+
| 1 | 2 |
请回答下列问题:
(1)下列说法正确的是
A.从原料消耗的角度来看,路线①制氢更有价值
B.从能量消耗的角度来看,路线①制氢更加有利
C.由于路线②制氢要消耗很多能量,故在实际生产中意义不大
D.路线①和路线②均使用催化剂,是为了降低反应所需的能量
(2)在体积为1L的密闭容器中充入2mol CO和4mol H2,一定条件下发生反应:
4H2(g)+2CO(g)?CH3CH2OH(g)+H2O(g)△H=-255.58kJ?mol-1
欲使n(CH3CH2OH)/n(CO)增大,应采取措施是
(3)若用0.81t淀粉为原料,理论上可制得质量分数为92%的乙醇溶液
(4)若用乙醇得到的合成气(CO、H2的混合气)来合成一种生物汽油.乙醇按路线①和路线②的反应各占50%,合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O
假定这种生物汽油中含有X、Y两种成分,且X、Y都是含8个碳原子的烃,X是苯的同系物,Y是烷烃.1t质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),最终可得到X的质量为多少吨?
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
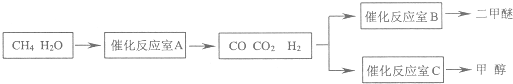
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)?CO(g)+3H2(g)…(I)
CO(g)+H2O(g)?CO2(g)+H2(g)…(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)?CH3OH(g)…(Ⅲ)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)…(Ⅳ)
①已知:原子利用率=
×100%,试求反应(Ⅳ)的原子利用率为
②反应(Ⅳ)的△S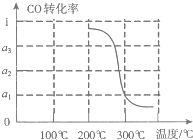
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的’转化率与温度的关系如图.则该反应的△H
(用含字母的代数式表示).
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:
CH3OCH3-12e-+16OH-=2CO2-3+11H2O.有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量
g
g.
查看习题详情和答案>>

(1)催化反应室B中CO与H2合成二甲醚的化学方程式为
2CO+4H2
CH3OCH3+H2O
| ||
| △ |
2CO+4H2
CH3OCH3+H2O
.
| ||
| △ |
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)?CO(g)+3H2(g)…(I)
CO(g)+H2O(g)?CO2(g)+H2(g)…(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)?CH3OH(g)…(Ⅲ)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)…(Ⅳ)
①已知:原子利用率=
| 预期产物的相对分子质量 |
| 全部生成物质的相对分子质量总和 |
64%
64%
.②反应(Ⅳ)的△S
<
<
0(填“>”、“=”或“<”).
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的’转化率与温度的关系如图.则该反应的△H
<
<
0(填“>”、“=”或“<”).300℃时该反应的平衡常数K=| a1V2 |
| 4a2(1-a1) |
| a1V2 |
| 4a2(1-a1) |
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:
CH3OCH3-12e-+16OH-=2CO2-3+11H2O.有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量
| 23V |
| 134.4 |
| 23V |
| 134.4 |