摘要:(1)配平下列离子方程式: I-x+ Cl2+ H2O --- Cl-+ IO+ 在反应中.若消耗I-x与Cl2物质的量之比为1∶8.则x= . (2)向MnSO4和硫酸的混合溶液里加入K2S2O8.溶液会发生如下反应: Mn2++S2O+H2O→MnO+SO+H+ 该反应常用于检验Mn2+的存在.其特征现象是 . 若反应中有0.1 mol还原剂参加反应.则消耗氧化剂物质的量为 mol. (3)若该反应所用的硫酸锰改为氯化锰.当它跟过量的过硫酸钾反应时.除有高锰酸钾.硫酸钾.硫酸生成外.其他的生成物还有 . (4)将NaBiO3固体加入到MnSO4和H2SO4的混合溶液里加热.固体溶解变为澄清溶液.发生如下反应: NaBiO3+ MnSO4+ H2SO4- Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O ①配平上述反应的化学方程式.并标出电子转移的方向和数目, ②上述反应中还原产物是
网址:http://m.1010jiajiao.com/timu_id_3980843[举报]
(1)配平下列离子反应方程式:
______Fe(OH)3+______ClO-+_______OH-![]() ______
______![]() +_____Cl-+_______H2O
+_____Cl-+_______H2O
(2)已知有0.03 mol Fe(OH)3参加反应,共转移了5.4×1022个电子,则n=_________,![]() 中铁元素的化合价为_________。
中铁元素的化合价为_________。
(3)根据(1)(2)推测,![]() 能和下列_________(填序号)物质反应。
能和下列_________(填序号)物质反应。
A.KMnO4 B.SO
(1)配平下列离子反应方程式:
________Fe(OH)3+________ClO-+________OH-![]() ________FeO4n-+________Cl-+________H2O
________FeO4n-+________Cl-+________H2O
(2)已知有3.21 g Fe(OH)3参加反应,共转移了5.4×1022个电子,则n=________,FeO4n-中铁元素的化合价为________.
(3)根据(1)、(2)推测,FeO4n-能和下列________(填序号)物质反应.
A.KMnO4 B.SO2 C.H2S D.O2
(1)配平下列离子反应方程式
________Fe(OH)3+________ClO-+________OH-→________FeO4n-+________Cl-+________H2O
(2)已知有10.7gFe(OH)3参加反应,共转移了0.3NA个电子,则n=________,FeO4n-中铁元素的化合价为________.
(3)根据前面的知识,推测FeO4n-能和下列________(填序号)物质反应.
A、KMnO4
B、SO2
C、H2S
D、O2
(2012?石家庄一模)目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点.
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,完成并配平下列离子方程式
(2)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和0H-未列出):
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2?7H20,过程如下:
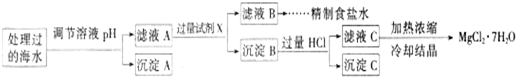
注:离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38 Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积变化忽略不计.
①表格中的a
②沉淀A的组成为
③加入的过量试剂X为
④加入过量HCl的作用为
查看习题详情和答案>>
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,完成并配平下列离子方程式
2
2
Fe(OH)3+3
3
ClO-+4OH-
4OH-
=2
2
FeO42-+3
3
Cl-+5H2O
5H2O
(2)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和0H-未列出):
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |

注:离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38 Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积变化忽略不计.
①表格中的a
>
>
0.16 (填“<”、“>”或“=”).②沉淀A的组成为
Fe(OH)3
Fe(OH)3
(填化学式)③加入的过量试剂X为
Ba(OH)2
Ba(OH)2
(填化学式)④加入过量HCl的作用为
使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解
使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解
.