摘要:氧化反应在负极发生.还原反应在正极发生.注意介质参与反应. 总的化学反应方程式是正负电极反应相加的结果.反过来也可以相减.得电极反应.电极反应也遵守质量守恒.电荷守恒及正.负极得失电子数相等的规律. 书写电极方程式时要注意几点:
网址:http://m.1010jiajiao.com/timu_id_3978697[举报]
氧化还原反应是重要的反应类型,下列有关说法正确的是
- A.1mol Al和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数)
- B.原电池的负极发生氧化反应,电解池的阳极发生还原反应
- C.Cu能被FeCl3溶液腐蚀,其离子方程式为:Cu+Fe3+=Cu2++Fe2+
- D.Na+、Ba2+、NO3-、SO32-四种离子在溶液中因发生氧化还原反应而不能大量共存
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+—e- =V3+,下列说法正确的是

A.放电时,右槽发生还原反应
B.放电时,左槽电解液pH升高
C.充电时,阴极的电极反应式:VO2++2H++e-=VO2++H2O
D.充电时,每转移1 mol电子,n(H+)的变化量为1 mol
查看习题详情和答案>>
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+—e- =V3+,下列说法正确的是
| A.放电时,右槽发生还原反应 |
| B.放电时,左槽电解液pH升高 |
| C.充电时,阴极的电极反应式:VO2++2H++e-=VO2++H2O |
| D.充电时,每转移1 mol电子,n(H+)的变化量为1 mol |
在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO3—、Fe2+、NH4+、H+、H2O,下列叙述正确的是
| A.该反应说明Fe(NO3)2溶液不宜加酸酸化 |
| B.该反应中氧化剂与还原剂物质的量之比为8:1 |
| C.若有1mol NO3—发生氧化反应,转移电子5mol |
| D.若将该反应设计成原电池,则负极反应为Fe3++e—=Fe2+ |
运用化学反应原理研究碳的氧化物的性质具有重要意义.
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高.下列措施不能够有效控制CO2所导致的温室效应的是
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.
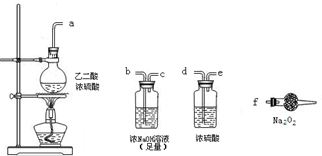
已知:H2C2O4
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1;CO(g)+
O2(g)=CO2(g),△H=-283.0kJ?mol-1,写出CO2 和C(s)反应的热化学方程式
查看习题详情和答案>>
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高.下列措施不能够有效控制CO2所导致的温室效应的是
④
④
(填序号)①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
ClO-+CO2+H2O=HClO+HCO3-;2HClO=2H++2Cl-+O2↑
ClO-+CO2+H2O=HClO+HCO3-;2HClO=2H++2Cl-+O2↑
.(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.

已知:H2C2O4
| ||
| △ |
abcf
abcf
;若CO能够与Na2O2发生反应,则预测反应产物为Na2CO3
Na2CO3
.(4)已知C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1;CO(g)+
| 1 |
| 2 |
CO2(g)+C(s)=2CO(g)△H=+172.5kJ?mol-1
CO2(g)+C(s)=2CO(g)△H=+172.5kJ?mol-1
.以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为CO+CO32-→2CO2+2e-
CO+CO32-→2CO2+2e-
.若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)11.2
11.2
L.