摘要:比较O2― 与F― 半径大小 [随堂练习]写出下列微粒的半径由大到小的顺序:F― .O2― .Na+ .Mg2+ [过]从以上的学习我们可以知道.随着元素原子序数的递增.元素的原子结构呈现周期性的变化.那么.元素的性质是否也会有周期性的变化呢?我们从元素的化合价(一种元素的原子在和其他元素一定数目的原子化合时所表现出来的性质)和金属性和非金属性两个方面来进行探讨. [投影] [问]请大家参考1-18号元素的原子结构示意图.结合上表同内容.能够发现哪些有关元素化合价知识的规律? [投影小结] (1) 最高正价与最外层电子数相等 (2) 最外层电子数≧4时出现负价 (3) 最高正化合价与负化合价绝对值和为8 (4) 金属元素无负价 (5) 氟无正价 [讲]大家总结很详细.要熟记这些知识.对于稀有气体元素.由于他们的化学性质不活泼.在通常状况下难与其他物质发生化学反应.因此.把它们的化合价看作是0. [投影小结]元素主要化合价变化规律性 原子序数 主要化合价的变化 1-2 +10 3-10 +1+5 -4-10 11-18 +1+7 -4-10 [板书]3.随着原子序数的递增.元素化合价呈现周期性变化 [过]元素的化学性质是由元素的原子结构决定的.原子结构决定了原子在参加化学反应时得失电子的难易程度.请大家根据己学知识分析3-9.11-17号元素.随原子序数的递增得失电子的难易程度 3-9.11-17号元素随原子序数的递增.原子半径逐渐变小.得电子能力逐渐增强.失电子能力逐渐减弱. [讲]我们知道.原子得失电子能力的强弱决定了元素金属性与非金属性强弱. [板书]4.随着原子序数的递增.元素金属性与非金属性呈现周期性变化 [讲]纵观以上结论.我们可归纳出这样一条规律: [板书]元素的性质随元素原子序数的递增呈现周期性变化.这个规律叫元素周期律. 元素周期律的实质: 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果. [总结]由于元素的性质是由组成该元素的原子结构决定的.元素的核外电子排布的周期性变化.决定了元素性质的周期性变化.这也是元素周期律的实质. [自我评价]
网址:http://m.1010jiajiao.com/timu_id_3978582[举报]
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.(1)阴影部分元素在元素周期表中的位置为
第ⅤA
第ⅤA
族.(2)根据元素周期律预测:H3AsO4属于强酸还是弱酸?
弱酸
弱酸
(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,试写出其完全燃烧的方程式
SiH4+2O2 =SiO2+2H2O
SiH4+2O2 =SiO2+2H2O
(4)O2与H2的反应是不可逆反应,而S与H2反应有一定限度,请写出Se与H2反应的化学方程式
Se+H2?H2Se
Se+H2?H2Se
(5)试比较S、O、F三种元素的原子半径大小:
S>O>F
S>O>F
(填元素符号).(2013?和平区二模)有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D元素在周期表中的位置为
(2)可以比较D和F得电子能力强弱的是
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有
 .
.
(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.
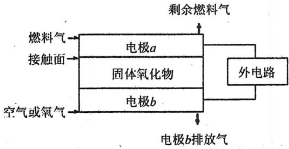
①固体氧化物中的O2-向
②电极b为电池
③若A2作为燃料气,则接触面上发生的反应为
④若B2A4作为燃料气,则接触面上发生的反应为
查看习题详情和答案>>
(1)D元素在周期表中的位置为
第二周期第VIA族
第二周期第VIA族
.(2)可以比较D和F得电子能力强弱的是
bc
bc
(填写编号).a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有
离子键、共价键
离子键、共价键
;并写出其中阳离子的电子式

(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ/mol
.(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.

①固体氧化物中的O2-向
负
负
(填“正”或“负”)极移动.②电极b为电池
正
正
极,其电极反应式为O2+4e-=2O2-
O2+4e-=2O2-
.③若A2作为燃料气,则接触面上发生的反应为
H2+O2--2e-=H2O
H2+O2--2e-=H2O
.④若B2A4作为燃料气,则接触面上发生的反应为
C2H4+6O2--12e-=2CO2+2H2O
C2H4+6O2--12e-=2CO2+2H2O
.1919年由Langmuir提出了等电子体.原子数相同、电子数相同的粒子,互称为等电子体.A、B、C、D、E、F 是原子序数依次增大的6种位于元素周期表前20号的元素.B、C、D、E位于同周期.C是空气中含量最多的元素.F与B、D都可形成XY2型离子化合物FB2、FD2,且都可与A2D(无色液体)反应放出气体.B22-与C2是等电子体,D22-与E2是等电子体.F原子的N层电子数与K层电子数相同.
(1)比较C、D、E对应的简单阴离子的半径(用离子符号表示)
(2)写出能证明D和E非金属性强弱的一个化学方程式
(3)由上述6种元素中的4种构成的离子化合物是(写出两种)
(4)写出与C2等电子体的分子的化学式为

(5)写出FD2与A2D反应的离子方程式:
查看习题详情和答案>>
(1)比较C、D、E对应的简单阴离子的半径(用离子符号表示)
N3->O2->F-
N3->O2->F-
(由大到小);(2)写出能证明D和E非金属性强弱的一个化学方程式
2F2+2H2O=4HF+O2
2F2+2H2O=4HF+O2
.(3)由上述6种元素中的4种构成的离子化合物是(写出两种)
NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca
NH4HCO3、(NH4)2CO3、Ca(HCO3)2、(CH3COO)2Ca
,其中所含的化学键类型有离子键、共价键
离子键、共价键
.(4)写出与C2等电子体的分子的化学式为
CO
CO
,写出B22-的电子式:

(5)写出FD2与A2D反应的离子方程式:
2CaO2+2H2O=2Ca(OH)2+O2↑
2CaO2+2H2O=2Ca(OH)2+O2↑
.下列比较关系与排列顺序错误的是( )
| A、酸性 H4SiO4<H3PO4<H2SO4<HClO4 | B、碱性 Ca(OH)2>Mg(OH)2>Al(OH)3 | C、稳定性SiH4>NH3>H2O>HF | D、半径 O2->F->Mg2+>Al3+ |