网址:http://m.1010jiajiao.com/timu_id_3978409[举报]
 (09江苏卷)下列有关实验操作的叙述正确的是:
(09江苏卷)下列有关实验操作的叙述正确的是:
A.实验室常用右图所示的装置制取少量的乙酸乙酯
B.用50mL酸式滴定管可准确量取25.00mLKMnO4 溶液
C.用量筒量取5.00mL1.00mol·L-1 盐酸于50mL容量瓶中,
加水稀释至刻度,可配制0.100mol·L-1 盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
查看习题详情和答案>>[2012·江苏卷] 常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO42-、CO32-
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO3-、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH4+、I-、SCN-
D.=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
查看习题详情和答案>>
(07年高考海南化学卷?13) 下表为元素周期表的一部分,请回答有关问题:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是______和_______;
(2)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的化学方程式:___________________________________,__________________________________________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:____________________________
_______________________________________________。
查看习题详情和答案>>[2012·江苏卷] 常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO42-、CO32- |
| B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO3-、Cl- |
| C.0.1 mol·L-1 FeCl3溶液:K+、NH4+、I-、SCN- |
| D.=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
[2012·江苏卷] (14分)废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO的部分实验过程如下: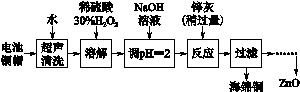
(2)①铜帽溶解时加入H2O2的目的是______ _____________________(用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法____ ___。
(3)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-===2CuI(白色)↓+I2
2S2O32-+I2===2I-+S4O62-
①滴定选用的指示剂为________,滴定终点观察到的现象____________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“ 不变”)。
已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO的实验步骤依次为:
①____________________________________________________________;
②__________________________________________________________________;
③过滤;
④___________________________________________________________________;
⑤过滤、洗涤、干燥;
⑥900 ℃煅烧。 查看习题详情和答案>>