摘要:17.离子方程式NH4++2H2OH3O++NH3•H2O所代表的是 A.氨水与盐酸溶液的反应 B.硫酸铵晶体溶于水 C.碳酸氢铵与过量的盐酸溶液反应 D.氯化铵溶液与过量氢氧化钠溶液反应
网址:http://m.1010jiajiao.com/timu_id_3976577[举报]
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出字母O代表的元素符号
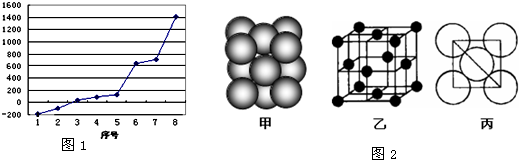
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(4)k与l形成的化合物kl2的电子式是
 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于
(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
(用M、NA、d表示).
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
查看习题详情和答案>>
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||

试回答下列问题:
(1)请写出字母O代表的元素符号
Fe
Fe
,该元素在周期表中的位置第四周期第 VIII族
第四周期第 VIII族
.(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
Si
Si
(填元素符号);其中电负性最大的是2
2
(填如图1中的序号).(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
SiC
SiC
(填化学式),试从结构角度加以解释:因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
.(4)k与l形成的化合物kl2的电子式是


分子
分子
晶体.(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
4
4
,该晶体的密度_
| ||
| 8NAd3 |
| ||
| 8NAd3 |
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
.现有部分短周期元素的性质或原子结构如下表:
(1)元素T的原子最外层共有
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
(3)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其他三种酸的是
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | M层p电子数比s电子数多2个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
6
6
种不同运动状态的电子.写出X原子的电子排布式1s22s22p2
1s22s22p2
.(2)元素Y与氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.(3)元素Z与元素T相比,非金属性较强的是
Cl
Cl
用元素符号表示),下列表述中能证明这一事实的是b
b
.a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其他三种酸的是
H2CO3
H2CO3
,理由是H2CO3为弱酸性或非氧化性酸
H2CO3为弱酸性或非氧化性酸
.原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是
(2)X与W组成的化合物中存在
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A与NaOH溶液反应的离子方程式
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为
②已知1mol?L-1 100mL B的溶液能与1mol?L-1 20mLKMnO4溶液(硫酸酸化)恰好反应.写出反应的离子方程式
查看习题详情和答案>>
(1)X元素是
H
H
(2)X与W组成的化合物中存在
共价
共价
键(填“离子”“共价”).(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
.(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A与NaOH溶液反应的离子方程式
NH4++OH-
H2O+NH3↑
| ||
NH4++OH-
H2O+NH3↑
.
| ||
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
.(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水.对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体.过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为
(NH4)2Fe(SO4)2?6H2O
(NH4)2Fe(SO4)2?6H2O
.②已知1mol?L-1 100mL B的溶液能与1mol?L-1 20mLKMnO4溶液(硫酸酸化)恰好反应.写出反应的离子方程式
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
.下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)f元素在周期表中的位置是
(2)b元素形成的同素异形体的晶体类型可能是(填序号)
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)e在空气中燃烧的产物所含化学键的类型为
(4)化合物ca3的电子式为
 ,ca3的催化氧化反应的化学方程式为
,ca3的催化氧化反应的化学方程式为
(5)a、c、d中的两种元素可组成具有10电子的多种分子和离子,写出其中两种离子反应生成两种分子的离子方程式
(6)由a、b、c、g四种元素中的三种元素组成的某种化合物,可与其中的第四种元素的单质发生反应,该反应的化学方程式为
查看习题详情和答案>>
| a | |||||||
| b | c | d | |||||
| e | f | g | |||||
第三
第三
周期第IIIA
第IIIA
族.(2)b元素形成的同素异形体的晶体类型可能是(填序号)
①③
①③
.①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)e在空气中燃烧的产物所含化学键的类型为
离子键、
离子键、
、共价键
共价键
.(4)化合物ca3的电子式为


4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
,若有1.25mol 电子发生转移,则参加反应的ca3的体积为
| ||
| △ |
5.6
5.6
L(标准状况).(5)a、c、d中的两种元素可组成具有10电子的多种分子和离子,写出其中两种离子反应生成两种分子的离子方程式
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||
(6)由a、b、c、g四种元素中的三种元素组成的某种化合物,可与其中的第四种元素的单质发生反应,该反应的化学方程式为
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
某无色待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等阳离子.某同学进行如下实验:
Ⅰ.加入过量的稀盐酸,有白色沉淀生成.
Ⅱ.过滤,取少许滤液,向其中加入过量的稀硫酸,又有白色沉淀生成.
Ⅲ.另取少量步骤II中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.
请回答下列问题:
(1)待测液中一定含有的离子是
(2)还有一种离子不能确定是否存在,检验这种离子的实验方法是
(3)请你写出“步骤Ⅲ”中产生气体的离子方程式
查看习题详情和答案>>
Ⅰ.加入过量的稀盐酸,有白色沉淀生成.
Ⅱ.过滤,取少许滤液,向其中加入过量的稀硫酸,又有白色沉淀生成.
Ⅲ.另取少量步骤II中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.
请回答下列问题:
(1)待测液中一定含有的离子是
Ag+、Ba2+、NH4+
Ag+、Ba2+、NH4+
,一定不含有的离子是Fe3+
Fe3+
.(2)还有一种离子不能确定是否存在,检验这种离子的实验方法是
焰色反应
焰色反应
,观察到的现象是透过透过蓝色的钴玻璃火焰呈紫色
透过透过蓝色的钴玻璃火焰呈紫色
.(3)请你写出“步骤Ⅲ”中产生气体的离子方程式
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||