摘要:反应方程式 基本类型 反应现象 用途 CaCO3+2HCl==CaCl2+H2O+CO2↑ 复分解 产生无色气泡,大理石逐渐溶解 实验室制取CO2,在大理石上"刻字" Na2CO3+2HCl==2NaCl+H2O+CO2↑ 复分解 反应剧烈,产生大量气泡,白色固体溶解 可治疗胃酸过多 CaCO3+H2SO4==CaSO4+H2O+CO2↑ 复分解 开始产生无色气泡,过一会儿,反应逐渐停止 大理石与硫酸在常温下反应,生成微溶于水的CaSO4.水和CO2,微溶的CaSO4会包住大理石,使反应停止(一般不用于制CO2) 高温 CaCO3====CaO+CO2↑ 分解 / 工业上用石灰石制取生石灰.CO2
网址:http://m.1010jiajiao.com/timu_id_3975085[举报]
碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法--“联合制碱法”.
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于 反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下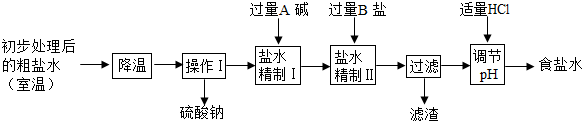
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是 .其反应化学方程示为 .
③“精制II”操作中,加入B盐的有关反应方程式为 .
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: .
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3
Na2CO3+H2O+CO2↑
查看习题详情和答案>>
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下

①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.

②“精制I”操作中,加入过量含钙元素的碱的化学式是
③“精制II”操作中,加入B盐的有关反应方程式为
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3
| ||
碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法--“联合制碱法”.
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于________反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是________.其反应化学方程示为________.
③“精制II”操作中,加入B盐的有关反应方程式为________.
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3
 Na2CO3+H2O+CO2↑
查看习题详情和答案>>
Na2CO3+H2O+CO2↑
查看习题详情和答案>>
碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法--“联合制碱法”.
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下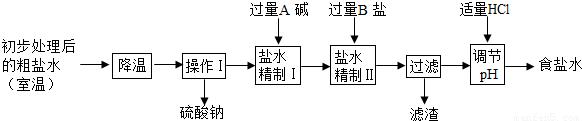
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是.其反应化学方程示为.
③“精制II”操作中,加入B盐的有关反应方程式为.
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式:.
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3 Na2CO3+H2O+CO2↑
查看习题详情和答案>>
Na2CO3+H2O+CO2↑
查看习题详情和答案>>
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下

①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.

②“精制I”操作中,加入过量含钙元素的碱的化学式是.其反应化学方程示为.
③“精制II”操作中,加入B盐的有关反应方程式为.
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3
 Na2CO3+H2O+CO2↑
查看习题详情和答案>>
Na2CO3+H2O+CO2↑
查看习题详情和答案>>
纯碱在化学工业中用途极广.工业上通常用氨碱法来生产.小红同学为探究纯碱的化学性质进行了猜想,并设计实验进行验证.请你帮助她将下列实验报告填写完整.
| 猜想 | 实验操作 | 实验现象 | 结论(或化学方程式) |
| 猜想一:Na2CO3溶液显碱性 | 取少量Na2CO3溶液于试管中,滴入2-3滴酚酞溶液,振荡 | 溶液变为红色 | 溶液显________性 |
| 猜想二:能与酸反应 | 取少量Na2CO3溶液于试管中,然后滴加稀盐酸 | ________ | 化学方程式 ________ |
| 猜想三:能与Ca(OH)2反应 | 取少量Na2CO3溶液于试管中,滴加澄清石灰水 | 产生 ________ | 化学方程式 ________ |
| 猜想四:能与BaCl2反应 | 取少量Na2CO3溶液于试管中,滴入BaCl2溶液 | 产生 ________ | 反应的基本类型 为________ |
纯碱在化学工业中用途极广.工业上通常用氨碱法来生产.小红同学为探究纯碱的化学性质进行了猜想,并设计实验进行验证.请你帮助她将下列实验报告填写完整.
查看习题详情和答案>>
| 猜想 | 实验操作 | 实验现象 | 结论(或化学方程式) |
| 猜想一:Na2CO3溶液显碱性 | 取少量Na2CO3溶液于试管中,滴入2-3滴酚酞溶液,振荡 | 溶液变为红色 | 溶液显______性 |
| 猜想二:能与酸反应 | 取少量Na2CO3溶液于试管中,然后滴加稀盐酸 | ______ | 化学方程式 ______ |
| 猜想三:能与Ca(OH)2反应 | 取少量Na2CO3溶液于试管中,滴加澄清石灰水 | 产生 ______ | 化学方程式 ______ |
| 猜想四:能与BaCl2反应 | 取少量Na2CO3溶液于试管中,滴入BaCl2溶液 | 产生 ______ | 反应的基本类型 为______ |
查看习题详情和答案>>