摘要: 在体积不变的密闭容器内.氮.氢合成氨反应达到平衡时.容器内有0.15 mol N2.0.45 mol H2.0.35 mol NH3.相同条件下.若向该容器中再充入0.15 mol N2.0.45 mol H2.0.35 mol NH3.则下列叙述正确的是 ( ) A. 正.逆反应速率同时增大.平衡时密度减小 B. 正反应速率增加倍数大于逆反应速率增加倍数.NH3的体积百分含量降低. C. 逆反应速率增加倍数大于正反应速率增加倍数.N2转化率降低. D. 重新平衡时.N2〈 0.3mol, NH3 〉0.7mol
网址:http://m.1010jiajiao.com/timu_id_3972795[举报]
在体积不变的密闭容器内,氮、氢合成氨反应达到平衡时,容器内有0.15 mol N2、0.45 mol H2、0.35 mol NH3。相同条件下,若向该容器中再充入0.15 mol N2、0.45 mol H2、0.35 mol NH3。则下列叙述正确的是
- A.正、逆反应速率同时增大,平衡时密度减小
- B.正反应速率增加倍数大于逆反应速率增加倍数,NH3的体积百分含量降低。
- C.逆反应速率增加倍数大于正反应速率增加倍数,N2转化率降低。
- D.重新平衡时,N2< 0.3mol, NH3>0.7mol
在体积不变的密闭容器内,氮、氢合成氨反应达到平衡时,容器内有0.15 mol N2、0.45 mol H2、0.35 mol NH3。相同条件下,若向该容器中再充入0.15 mol N2、0.45 mol H2、0.35 mol NH3。则下列叙述正确的是 ( )
A.正、逆反应速率同时增大,平衡时密度减小
B.正反应速率增加倍数大于逆反应速率增加倍数,NH3的体积百分含量降低。
C.逆反应速率增加倍数大于正反应速率增加倍数,N2转化率降低。
D.重新平衡时,N2< 0.3mol, NH3 >0.7mol
查看习题详情和答案>>在体积不变的密闭容器内,氮、氢合成氨反应达到平衡时,容器内有0.15 mol N2、0.45 mol H2、0.35 mol NH3。相同条件下,若向该容器中再充入0.15 mol N2、0.45 mol H2、0.35 mol NH3。则下列叙述正确的是 ( )
| A.正、逆反应速率同时增大,平衡时密度减小 |
| B.正反应速率增加倍数大于逆反应速率增加倍数,NH3的体积百分含量降低。 |
| C.逆反应速率增加倍数大于正反应速率增加倍数,N2转化率降低。 |
| D.重新平衡时,N2< 0.3mol, NH3>0.7mol |
合成氨反应原理为:1/2N2(g)+3/2H2(g) NH3(g) △H=xkJ/mol。请回答:
NH3(g) △H=xkJ/mol。请回答:
(1)为提高上述反应的速率,工业上常采用催化剂。目前,最好的催化剂组成为n(Fe2+):n(Fe3+)=0.5,若以FeO、Fe2O3和Fe3O4为原料,则三者的物质的量之比为___________________。
(2)将N2及H2按物质的量之比1:3充入密闭容器中,相等时间内,不同温度下,在催化剂表面反应,N2的转化率与反应温度的关系如图1所示,下列说法正确的是______________。
 NH3(g) △H=xkJ/mol。请回答:
NH3(g) △H=xkJ/mol。请回答:(1)为提高上述反应的速率,工业上常采用催化剂。目前,最好的催化剂组成为n(Fe2+):n(Fe3+)=0.5,若以FeO、Fe2O3和Fe3O4为原料,则三者的物质的量之比为___________________。
(2)将N2及H2按物质的量之比1:3充入密闭容器中,相等时间内,不同温度下,在催化剂表面反应,N2的转化率与反应温度的关系如图1所示,下列说法正确的是______________。

A.△H<0
B.v(N2)=2v(NH3)时,说明已达平衡
C.该催化剂约在500℃时活性较大
D.若增大压强,N2的转化率一定提高
(3)已知:保持温度、容积不变时,各气体的压强(分压)与它们的物质的量成正比。若用Kp表示平衡常数,p(N2)、p(H2)、p(NH3)分别表示N2、H2、NH3的分压。 写出上述反应的平衡常数表达式:
Kp=____。
(4)合成氨工业中,平衡耐NH3的含量[用φ(NH3)表示]与反应的总压、温度、氢氮比[用γ= n(H2)/n(N2)表示]和惰性气体含量(用xi表示)存在一定关系。下列两图是探究γ、xi对合成氨生产影响时所得到的。
B.v(N2)=2v(NH3)时,说明已达平衡
C.该催化剂约在500℃时活性较大
D.若增大压强,N2的转化率一定提高
(3)已知:保持温度、容积不变时,各气体的压强(分压)与它们的物质的量成正比。若用Kp表示平衡常数,p(N2)、p(H2)、p(NH3)分别表示N2、H2、NH3的分压。 写出上述反应的平衡常数表达式:
Kp=____。
(4)合成氨工业中,平衡耐NH3的含量[用φ(NH3)表示]与反应的总压、温度、氢氮比[用γ= n(H2)/n(N2)表示]和惰性气体含量(用xi表示)存在一定关系。下列两图是探究γ、xi对合成氨生产影响时所得到的。
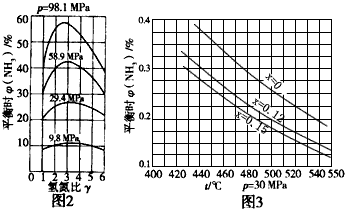
根据图2,可得出的结论是:_______。 根据图3,可得出的结论是:________。
查看习题详情和答案>>
(10分) )氮元素有着多变价态和种类繁多的化合物,因在生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298 K | 398 K | 498 K | … |
| K | 4.1×106 | K1 | K2 | … |
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
A.2v(H2)正=3v(NH3)逆 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡常数_____。(填“增大”、“减小”或“不变”)
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)____ Ksp(AgBr) (填“>”、“=”或“<”)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式____________________。 查看习题详情和答案>>