摘要:答案:(1)A:NH4HSO3或(NH4)2SO3 B:NH4HSO4或(NH4)2SO4 C:SO2 D:NH3 E:K2SO3 F:K2SO4 (2)SO+Br2+H2O===SO+2Br-+2H+ (3)通过焰色反应鉴定K+,取少量F的溶液加入氯化钡和盐酸的溶液.若产生白色沉淀.证明SO的存在 解析:这个图示看起来复杂.实际上若能迅速找到突破点.问题并不难解. A溶液既能与浓硫酸反应.又能与氢氧化钾反应.说明它的阴离子和阳离子为含有弱电解质的离子或能被氧化的离子.反应中都有气体产生.说明阴.阳离子都具挥发性.无色气体C与氨水反应.D又与C的溶液反应.可见D为NH3.C为CO.HCO或SO.HSO等.E与溴水反应.所以排除CO.E是K2SO3.F即为K2SO4.这样其他问题均可得出答案. ●命题趋向与应试策略
网址:http://m.1010jiajiao.com/timu_id_3972483[举报]
常温下,有甲、乙两份体积均为1L,pH均为3的溶液,其中甲为醋酸,乙为盐酸.
①甲用蒸馏水稀释至100倍后,溶液的pH变为a;
②乙与等体积、浓度为1.5mol/L的氨水混合,在此混合液中:n(NH
)+n(H+)-n(OH-)=b mol.
则a、b正确的答案组合是( )
①甲用蒸馏水稀释至100倍后,溶液的pH变为a;
②乙与等体积、浓度为1.5mol/L的氨水混合,在此混合液中:n(NH
+ 4 |
则a、b正确的答案组合是( )
查看习题详情和答案>>
I.下列说法正确的是 (填字母编号,每小题只有一个正确答案,下同)
A.离子晶体中一定存在离子键,分子晶体中一定存在共价键
B.主族元素形成的单质,从上到下熔沸点逐渐升高
C.N2分子中的共价键是由两个σ键和一个π键组成的
D.以极性键结合的分子不一定是极性分子
II.下列叙述正确的是 .
A.用VSERP理论预测PCl3的立体构型为平面三角形
B.SO2和CO2都是含有极性键的非极性分子
C.在NH+4和[Cu(NH3)4]2+中都存在配位键
D.铝元素的原子核外共有5种不同运动状态的电子
III.Q、R、X、Y、Z五种元素的原子序数逐渐增大.已知Z的原子序数为29,其余均为短周期主族元素.Y原子的价电子排布为msnmpn.R原子核外L层的电子数为奇数,Q、X原子p轨道的电子数分别为2和4.请回答下列问题: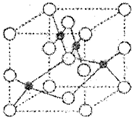
(1)Z2+的核外电子排布式是 .如图是Z和X形成晶体的晶胞结构示意图(O代表X),可确定该晶胞中阴离子的个数为 .
(2)Q与Y形成的最简单气态氢化物分别为A、B,试比较它们的热稳定性并说明理由:
.
(3)Q和X形成的一种化合物甲的相对分子质量为44,则甲的空间构型是 ,中心原子采取的杂化轨道类型是 ,该分子中含有 个π键.
(4)R有多种氧化物,其中乙的相对分子质量最小.在一定条件下,2L的乙气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 .
(5)这五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 晶体;Q、R、X三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
查看习题详情和答案>>
A.离子晶体中一定存在离子键,分子晶体中一定存在共价键
B.主族元素形成的单质,从上到下熔沸点逐渐升高
C.N2分子中的共价键是由两个σ键和一个π键组成的
D.以极性键结合的分子不一定是极性分子
II.下列叙述正确的是
A.用VSERP理论预测PCl3的立体构型为平面三角形
B.SO2和CO2都是含有极性键的非极性分子
C.在NH+4和[Cu(NH3)4]2+中都存在配位键
D.铝元素的原子核外共有5种不同运动状态的电子
III.Q、R、X、Y、Z五种元素的原子序数逐渐增大.已知Z的原子序数为29,其余均为短周期主族元素.Y原子的价电子排布为msnmpn.R原子核外L层的电子数为奇数,Q、X原子p轨道的电子数分别为2和4.请回答下列问题:

(1)Z2+的核外电子排布式是
(2)Q与Y形成的最简单气态氢化物分别为A、B,试比较它们的热稳定性并说明理由:
(3)Q和X形成的一种化合物甲的相对分子质量为44,则甲的空间构型是
(4)R有多种氧化物,其中乙的相对分子质量最小.在一定条件下,2L的乙气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
(5)这五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
|
常温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol/L的氨水,其pH为11.①甲用蒸馏水稀释至1/100后,溶液的pH变为a;②乙与等体积、浓度为0.2 mol/L的盐酸混合,在混合液中n(NH | |
| [ ] | |
A. |
9~11;0.1 |
B. |
9~11;0.2 |
C. |
12~13;0.2 |
D. |
13;0.1 |