摘要:Fe粉在O2/水蒸汽中加热 3Fe2+O2Fe3O4 3Fe+4H2O(g) Fe3O4+4H2
网址:http://m.1010jiajiao.com/timu_id_3971036[举报]
(15分)依据事实,写出下列反应的热化学方程式。
(1)1molN2(气态)与适量H2 (气态)起反应,生成 NH3(气态),放出92.2 kJ的热量;
(2)卫星发射时可用N2H4为燃料。1molN2H4(气态)在O2 (气态)中燃烧,生成N2 (气态)和H2O(气态),放出534kJ的热量;
(3).在101kPa时,4.0g硫粉在O2中完全燃烧生成SO2,放出37kJ的热量,S的燃烧热为______,S燃烧的热化学方程式为_____ _。
 为了制得较纯净的Fe(OH)2,甲乙两同学分别用下面两种方法制得白色的Fe(OH)2沉淀.
为了制得较纯净的Fe(OH)2,甲乙两同学分别用下面两种方法制得白色的Fe(OH)2沉淀.同学甲:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
Fe粉
Fe粉
.(2)除去蒸馏水中溶解的O2常采用
加热
加热
的方法.(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.
同学乙:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.A管中是Fe和H2SO4,B管中是NaOH溶液.
(4)先打开a,使A管中反应一段时间后再夹紧止水夹a,这样做的目的是
A管中产生的气体通入B管中排尽B管中的空气,使B充满还原性气体氢气
A管中产生的气体通入B管中排尽B管中的空气,使B充满还原性气体氢气
.(5)A管中发生反应的离子方程式为
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
(6)B管中生成沉淀的离子方程式为
Fe2++2OH-=Fe(OH)2↓
Fe2++2OH-=Fe(OH)2↓
.(7)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
试管A中反应生成的H2充满了A试管和B试管,且外界空气不容易进入
试管A中反应生成的H2充满了A试管和B试管,且外界空气不容易进入
. Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是
Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是白色沉淀先变成灰绿色,最后变成红褐色
白色沉淀先变成灰绿色,最后变成红褐色
,反应的化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.实验室可用下面两种方法制得白色的Fe(OH)2沉淀:方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)若FeSO4溶液中含有Fe3+,可加入Fe粉使其还原,反应的离子方程式是
2Fe3++Fe=3Fe 2+
2Fe3++Fe=3Fe 2+
.(2)除去蒸馏水中溶解的O2常采用
煮沸
煮沸
的方法.(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是
避免生成的Fe(OH)2沉淀接触O2
避免生成的Fe(OH)2沉淀接触O2
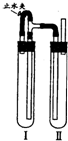
.方法二:在如图装置中,试管Ⅰ里加入铁屑、稀H2SO4,试管Ⅱ里加入NaOH溶液,为了制得白色Fe(OH)2沉淀,实验时打开止水夹,塞紧塞子后的实验步骤是
检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹
检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹
.这样生成的Fe(OH)2沉淀能较长时间保持白色. 某同学采用如图所示装置进行Fe粉与水蒸气的反应.
某同学采用如图所示装置进行Fe粉与水蒸气的反应.(1)写出Fe粉与水蒸气反应的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2↑
| ||
3Fe+4H2O(g)
Fe3O4+4H2↑
.
| ||
(2)该同学向反应后的固体中加入过量的稀HCl,并将溶液分装在两支试管中.
①向第一支试管中滴加KSCN溶液,溶液呈红色,该溶液中存在的阳离子有
Fe3+、Fe2+、H+;
Fe3+、Fe2+、H+;
.②向第二支试管中加入适量铁粉.该过程中发生化合反应的离子方程式是
2Fe3++Fe═3 Fe2+
2Fe3++Fe═3 Fe2+
.再向所得溶液中滴加NaOH溶液并放置一段时间,该步反应中的实验现象是
产生白色沉淀,迅速变成灰绿色,最终变成红褐色
产生白色沉淀,迅速变成灰绿色,最终变成红褐色
.发生的氧化还原反应的化学方程式是4Fe(OH)2+O2+2 H2O═4 Fe(OH)3 ;
4Fe(OH)2+O2+2 H2O═4 Fe(OH)3 ;
.(I)按照如图1所示装置进行有关实验,拔掉分液漏斗玻璃塞,将A逐滴加入B中.
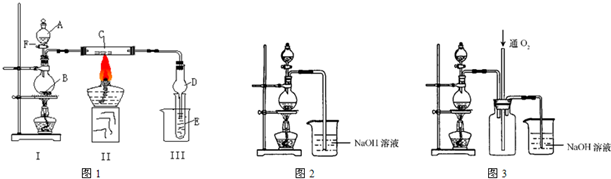
若A是浓盐酸,B为二氧化锰,当将A滴入B中时发生反应的离子方程式为:
当实验一段时间后,发现C、D中有红棕色烟,则C的化学式为:
(II)硫酸铜是一种应用极其广泛的化工原料,可通过多种途径制取硫酸铜晶体.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图2所示).
请回答相关问题:
(1)图2分液漏斗中装的液体是
(2)本实验中若硝酸过量,造成的结果是
(3)图3是图2的改进装置,其优点是①
(4)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:将铜粉在某仪器中反复灼烧,使铜粉与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向混合物中加入Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,得硫酸铜晶体,滤渣循环使用〔已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4〕.
①方案1中用于灼烧铜粉的仪器名称是
②方案2中甲物质可以是
a.CuO b.CuCO3 c.CaCO3 d.NaOH
③方案2中发生反应的总化学方程式为(注明反应条件)
查看习题详情和答案>>

若A是浓盐酸,B为二氧化锰,当将A滴入B中时发生反应的离子方程式为:
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
;
| ||
当实验一段时间后,发现C、D中有红棕色烟,则C的化学式为:
Fe
Fe
.(II)硫酸铜是一种应用极其广泛的化工原料,可通过多种途径制取硫酸铜晶体.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图2所示).
请回答相关问题:
(1)图2分液漏斗中装的液体是
浓硝酸
浓硝酸
;(2)本实验中若硝酸过量,造成的结果是
制得的硫酸铜晶体不纯
制得的硫酸铜晶体不纯
;(3)图3是图2的改进装置,其优点是①
有利于氮氧化合物的吸收
有利于氮氧化合物的吸收
,②防止倒吸
防止倒吸
;(4)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:将铜粉在某仪器中反复灼烧,使铜粉与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向混合物中加入Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,得硫酸铜晶体,滤渣循环使用〔已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4〕.
①方案1中用于灼烧铜粉的仪器名称是
坩埚
坩埚
;②方案2中甲物质可以是
ab
ab
(填字母序号);a.CuO b.CuCO3 c.CaCO3 d.NaOH
③方案2中发生反应的总化学方程式为(注明反应条件)
2Cu+O2+2H2SO4
2CuSO4+2H2O
| ||
2Cu+O2+2H2SO4
2CuSO4+2H2O
.
| ||