网址:http://m.1010jiajiao.com/timu_id_3967923[举报]
(15分)广义的化学反应速率可以用参加化学反应的任一种物质“在单位时间内某一可测的物理量的变化量”来表示,即V(A) = ![]() ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
可选用试剂及规格:纯锌、粗锌(含铜杂质)、1mol/L 稀硫酸、2mol/L 稀硫酸,
反应温度:250C、350C
(1)请写出锌和硫酸反应的离子方程式
(2)为表达锌和硫酸反应快慢,该学习小组设计了如下表格,请填充表格丁、戊、己三处。
| 编号 | 反应速率表达式的定义 | 反应速率表达式 | 反应速率单位 |
| ① | 单位时间内H+浓度的变化量 | V(H+) = | mol / L.min |
| ② | 丁 | 戊 | 己 |
| ③ | 单位时间内生成H2标况下的体积 | V(H2) = | L / min |
(3)该学习小组选用0.1 mol Zn和200 mL 1mol/L 稀硫酸(硫酸过量)在250C反应进行研究,用秒表计时,至锌块完全溶解且溶液中不再有气泡放出时,记录反应时间为5分钟,该反应速率V(H+) =
(4)该小组对“影响反应速率的因素”进行了分析,设计如下系列实验,庚辛壬癸四处空白。
| 编号 | 锌的形状 | 锌的规格 | 硫酸的浓度 | 反应温度 | 实验设计的目的 |
| ① | 块状 | 纯锌 | 1mol/L | 250C | 实验①和②研究的目的是 庚 ;
实验②和③研究硫酸浓度对反应速率影响; 实验③和④研究锌的规格对反应速率影响;
实验④和⑤研究的目的是 癸 ;
|
| ② | 颗粒状 | 纯锌 | 1mol/L | 250C | |
| ③ | 颗粒状 | 纯锌 | 辛 | 250C | |
| ④ | 颗粒状 | 壬 | 2mol/L | 250C | |
| ⑤ | 颗粒状 | 粗锌 | 2mol/L | 350C | |
| …… |
查看习题详情和答案>>
(15分)广义的化学反应速率可以用参加化学反应的任一种物质“在单位时间内某一可测的物理量的变化量”来表示,即V(A) =  ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
可选用试剂及规格:纯锌、粗锌(含铜杂质)、1mol/L 稀硫酸、2mol/L 稀硫酸,
反应温度:250C 、350C
(1)请写出锌和硫酸反应的离子方程式
(2)为表达锌和硫酸反应快慢,该学习小组设计了如下表格,请填充表格丁、戊、己三处。
| 编号 | 反应速率表达式的定义 | 反应速率表达式 | 反应速率单位 |
| ① | 单位时间内H+浓度的变化量 | V(H+) = | mol / L.min |
| ② | 丁 | 戊 | 己 |
| ③ | 单位时间内生成H2标况下的体积 | V(H2) =  | L / min |
(3)该学习小组选用0.1 mol Zn和200 mL 1mol/L 稀硫酸(硫酸过量)在250C反应进行研究,用秒表计时,至锌块完全溶解且溶液中不再有气泡放出时,记录反应时间为5分钟,该反应速率V(H+) =
(4)该小组对“影响反应速率的因素”进行了分析,设计如下系列实验,庚辛壬癸四处空白。
| 编号 | 锌的形状 | 锌的规格 | 硫酸的浓度 | 反应温度 | 实验设计的目的 |
| ① | 块状 | 纯锌 | 1mol/L | 250C | 实验①和②研究的目的是 庚 ; 实验②和③研究硫酸浓度对反应速率影响; 实验③和④研究锌的规格对反应速率影响; 实验④和⑤研究的目的是 癸 ; |
| ② | 颗粒状 | 纯锌 | 1mol/L | 250C | |
| ③ | 颗粒状 | 纯锌 | 辛 | 250C | |
| ④ | 颗粒状 | 壬 | 2mol/L | 250C | |
| ⑤ | 颗粒状 | 粗锌 | 2mol/L | 350C | |
| …… | |||||
(15分)广义的化学反应速率可以用参加化学反应的任一种物质“在单位时间内某一可测的物理量的变化量”来表示,即V(A) =  ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。

可选用试剂及规格:纯锌、粗锌(含铜杂质)、1mol/L 稀硫酸、2mol/L 稀硫酸,
反应温度:250C 、350C
(1)请写出锌和硫酸反应的离子方程式
(2)为表达锌和硫酸反应快慢,该学习小组设计了如下表格,请填充表格丁、戊、己三处。
|
编号 |
反应速率表达式的定义 |
反应速率表达式 |
反应速率单位 |
|
① |
单位时间内H+浓度的变化量 |
V(H+) = |
mol / L.min |
|
② |
丁 |
戊 |
己 |
|
③ |
单位时间内生成H2标况下的体积 |
V(H2) = |
L / min |
(3)该学习小组选用0.1 mol Zn和200 mL 1mol/L 稀硫酸(硫酸过量)在250C反应进行研究,用秒表计时,至锌块完全溶解且溶液中不再有气泡放出时,记录反应时间为5分钟,该反应速率V(H+) =
(4)该小组对“影响反应速率的因素”进行了分析,设计如下系列实验,庚辛壬癸四处空白。
|
编号 |
锌的形状 |
锌的规格 |
硫酸的浓度 |
反应温度 |
实验设计的目的 |
|
① |
块状 |
纯锌 |
1mol/L |
250C |
实验①和②研究的目的是 庚 ;
实验②和③研究硫酸浓度对反应速率影响; 实验③和④研究锌的规格对反应速率影响;
实验④和⑤研究的目的是 癸 ;
|
|
② |
颗粒状 |
纯锌 |
1mol/L |
250C |
|
|
③ |
颗粒状 |
纯锌 |
辛 |
250C |
|
|
④ |
颗粒状 |
壬 |
2mol/L |
250C |
|
|
⑤ |
颗粒状 |
粗锌 |
2mol/L |
350C |
|
|
…… |
查看习题详情和答案>>
广义的化学反应速率可以用参加化学反应的任一种物质“在单位时间内某一可测的物理量的变化量”来表示,即V(A) = ![]() ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。

可选用试剂及规格:纯锌、粗锌(含铜杂质)、1mol/L 稀硫酸、2mol/L 稀硫酸,
反应温度:250C 、350C
(1)请写出锌和硫酸反应的离子方程式
(2)为表达锌和硫酸反应快慢,该学习小组设计了如下表格,请填充表格丁、戊、己三处。
| 编号 | 反应速率表达式的定义 | 反应速率表达式 | 反应速率单位 |
| ① | 单位时间内H+浓度的变化量 | V(H+) = | mol / L.min |
| ② | 丁 | 戊 | 己 |
| ③ | 单位时间内生成H2标况下的体积 | V(H2) = | L / min |
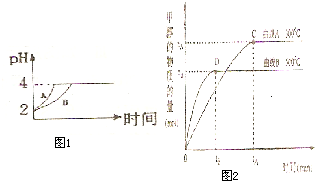 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)=4C (g)△H>0 达到平衡时,c(A)=2mol?L-1,c(B)=7mol?L-1,c(C)=4mol?L-1.试确定B的起始浓度c(B)的取值范围是
A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是
(3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)→CH3OH(g).反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
(4)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:
Cu(OH)2(s)=Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)[c(OH-)]2=2×10-20
当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c( Cu2+)=0.02mol?L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于
(5)常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色.则该溶液呈

