摘要:常见分子.离子的空间构型:Cl2.HCl.H2O.H2S.NH3.CH4.SiH4.BeCl2.BF3.CO2.SO2.CH2O.HCN.H3O+.NH4+. 正四面体型,平面三角型,三角锥型,V型,直线型
网址:http://m.1010jiajiao.com/timu_id_3967898[举报]
 以海水中常见物质A为原料可以发展很多工业,图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题.
以海水中常见物质A为原料可以发展很多工业,图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题.(1)C和D、C和G反应都可以制取消毒剂.C和D反应制取的消毒剂中有效成分的化学式为
NaClO
NaClO
.(2)电解A溶液反应的离子方程式为
2H2O+2Cl-
Cl2↑+H2↑+2OH-
| ||
2H2O+2Cl-
Cl2↑+H2↑+2OH-
.
| ||
(3)将F和J通入A的饱和溶液中,反应的化学方程式为:
NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
.(4)J的空间构型为
三角锥
三角锥
形.(5)空气分离出H后剩余气体的最主要成分是
O2
O2
,有可以将其与B及D组成燃料电池,则该电池的负极反应式:2H2+4OH--4e-═4H2O
2H2+4OH--4e-═4H2O
;正极反应式:O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.以海水中常见物质A为原料可以发展很多工业生产,如图中包含了中学课本中介绍的几种基本工业生产,请根据如图各物质之间的转化关系回答下列问题.

(1)C和D、C和G反应都可以制取消毒剂.写出C和G反应制取消毒剂的化学反应方程式:
(2)电解A溶液反应的离子方程式为
(3)J分子的空间构型为
(4)实验室可用K与G固体加热制取J,写出该反应化学方程式:
查看习题详情和答案>>

(1)C和D、C和G反应都可以制取消毒剂.写出C和G反应制取消毒剂的化学反应方程式:
2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
.(2)电解A溶液反应的离子方程式为
2H2O+2Cl-
Cl2↑+H2↑+2OH-
| ||
2H2O+2Cl-
Cl2↑+H2↑+2OH-
.若该反应中转移电子数为8NA,则产生的氯气在标准状况下体积为
| ||
89.6
89.6
L.(3)J分子的空间构型为
三角锥
三角锥
.(4)实验室可用K与G固体加热制取J,写出该反应化学方程式:
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
| ||
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
.
| ||
甲、乙、丙、丁、戊都是单质,其中甲、乙、丙是常见金属,丁和戊是气体,且丁呈黄绿色.A~K是化合物.F是红褐色沉淀,G是淡黄色固体粉末,K是丁的气态氢化物.已知乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns1.它们之间有如图1的转化关系(部分反应物或产物省略).
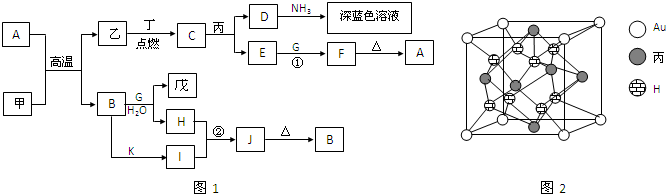
回答以下问题:
(1)G的电子式:
 ,深蓝色溶液中溶质的化学式:
,深蓝色溶液中溶质的化学式:
(2)甲与同周期的金属元素相比,第一电离能由小到大的顺序是
(3)完成反应方程式
反应①中,E和G的物质的量之比为2:1:
反应②的离子方程式:
(4)乙的高价阳离子的最高能级电子排布图为:
 .检验该离子常用KSCN溶液.乙的高价阳离子与SCN-可形成配位数不同的多种配合物.在含0.01molC的溶液中,加入100mL0.34mol?L-1的KSCN溶液,所得配合物是下列中的
.检验该离子常用KSCN溶液.乙的高价阳离子与SCN-可形成配位数不同的多种配合物.在含0.01molC的溶液中,加入100mL0.34mol?L-1的KSCN溶液,所得配合物是下列中的
①[Fe(SCN)]2+;②[Fe(SCN)2]+;③Fe(SCN)3;④[Fe(SCN)4]-;⑤[Fe(SCN)5]2-;⑥[Fe(SCN)6]3-
(5)丙的基态原子电子排布式为
查看习题详情和答案>>

回答以下问题:
(1)G的电子式:


[Cu(NH3)4]Cl2
[Cu(NH3)4]Cl2
.(2)甲与同周期的金属元素相比,第一电离能由小到大的顺序是
Na<Al<Mg
Na<Al<Mg
(用元素符号表示).(3)完成反应方程式
反应①中,E和G的物质的量之比为2:1:
3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl
3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl
;反应②的离子方程式:
3AlO2-+Al3++6H2O=4Al(OH)3↓
3AlO2-+Al3++6H2O=4Al(OH)3↓
.(4)乙的高价阳离子的最高能级电子排布图为:


③④
③④
(选填序号),其物质的量之比为3:2
3:2
.①[Fe(SCN)]2+;②[Fe(SCN)2]+;③Fe(SCN)3;④[Fe(SCN)4]-;⑤[Fe(SCN)5]2-;⑥[Fe(SCN)6]3-
(5)丙的基态原子电子排布式为
1s22s22p63s23p63d104s1或[Ar]3d104s1
1s22s22p63s23p63d104s1或[Ar]3d104s1
.丙与金形成的一种合金晶体具有立方最密堆积的结构,这种晶体具有储氢功能,氢原子可进入到由丙原子与Au原子构成的四面体空隙中.其晶胞结构如图2所示.这种合金晶体储氢后的化学式应为AuCu3H8
AuCu3H8
.[化学—选修3物质结构与性质](15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| | 氟 | 氯 | 溴 | 碘 | 铍 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为_____,孤电子对对数为______, I3-离子的空间构型为___________。
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。 A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)下图为碘晶体晶胞结构。有关说法中正确的是_____________。

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(8)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
 查看习题详情和答案>>
查看习题详情和答案>>
已知由短周期元素组成的六种微粒A、B、C、D、E、F其所含原子核数目依次为2、3、4、5、1、1.其中A、B、E各含有18个电子,C、D、F各含有10个电子,A、B、C、D为常见化合物.请回答:
(1)D分子的空间构型为
(2)将B缓慢通入Cu(OH)2悬浊液中,浑浊液变为黑色,相应的化学方程式为
(3)A、C混合可生成一种新的化合物,该化合物中含有的化学键类型有
(4)①若E、F可按1:1组成离子化合物X,其水溶液呈中性.请写出电解X溶液的化学方程式:
②若Y溶液中所有离子间有以下关系:c(H+)+3c(F)=c(OH-)+c(E),则:Y溶液的pH
查看习题详情和答案>>
(1)D分子的空间构型为
正四面体
正四面体
.(2)将B缓慢通入Cu(OH)2悬浊液中,浑浊液变为黑色,相应的化学方程式为
H2S+Cu(OH)2=CuS+2H2O
H2S+Cu(OH)2=CuS+2H2O
.(3)A、C混合可生成一种新的化合物,该化合物中含有的化学键类型有
离子键、共价键
离子键、共价键
;室温下,将pH=a的C的稀溶液与pH=14-a的A稀溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+)
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
.(4)①若E、F可按1:1组成离子化合物X,其水溶液呈中性.请写出电解X溶液的化学方程式:
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
| ||
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
;电解时,阳极收集到的气体体积小于阴极,原因是
| ||
部分Cl2与NaOH溶液发生了反应而消耗
部分Cl2与NaOH溶液发生了反应而消耗
.②若Y溶液中所有离子间有以下关系:c(H+)+3c(F)=c(OH-)+c(E),则:Y溶液的pH
小于
小于
7(填“大于”、“小于”或“等于”),原因是(用离子方程式表示)Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.