网址:http://m.1010jiajiao.com/timu_id_3964767[举报]

(1)A、B、C三套装置中,应选用的装置是
(2)为了防止氯气污染环境,图中所示的溶液甲为
(3)要制得纯净干燥的氯气,需要在气体发生装置和收集装置间增加净化装置,请将下面提供仪器的导管接口按次序连接:
气体发生装置→

(4)工业上用电解饱和食盐水的方法制备氯气,写出其化学反应原理,并用“双线桥法”标出电子转移的方向和数目


工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]已去除表面氧化物的铁钉(碳素钢)放入浓硫酸中,加热,充分反应后收集到气体Y。某同学认为气体Y中除了SO2外还可能含有H2和CO2气体,为此设计了下列实验装置,探究Y中H2和CO2的存在(图中夹持仪器省略)。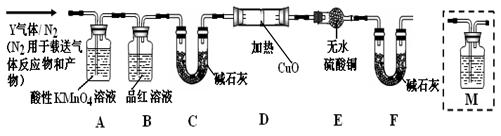
(1)装置B中试剂的作用是 。
(2)认为气体Y中还含有CO2的理由是 (用化学方程式表示)。
(3)为确认CO2的存在,需在装置中添加M于 (选填序号)。
a.. A之前 b . A-B间 c . B-C间 d . C-D间
(4)如果气体Y中含有H2,预计实验现象应是 。
[探究二] SO2气体还原Fe3+、I2,使用的药品和装置如下图所示: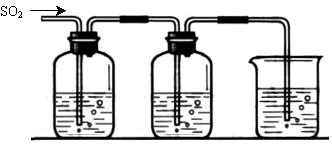
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(5)装置C的作用是 。
(6)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发浓缩、冷却结晶、 、洗涤、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
| A.蒸发皿 | B.石棉网 | C.漏斗 | D.烧杯 E.玻璃棒 F. 坩埚 |
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是 (8)能表明I-的还原性弱于SO2的现象是 。 查看习题详情和答案>>
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]已去除表面氧化物的铁钉(碳素钢)放入浓硫酸中,加热,充分反应后收集到气体Y。某同学认为气体Y中除了SO2外还可能含有H2和CO2气体,为此设计了下列实验装置,探究Y中H2和CO2的存在(图中夹持仪器省略)。

(1)装置B中试剂的作用是 。
(2)认为气体Y中还含有CO2的理由是 (用化学方程式表示)。
(3)为确认CO2的存在,需在装置中添加M于 (选填序号)。
a.. A之前 b . A-B间 c . B-C间 d . C-D间
(4)如果气体Y中含有H2,预计实验现象应是 。
[探究二] SO2气体还原Fe3+、I2,使用的药品和装置如下图所示: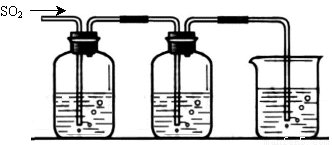
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(5)装置C的作用是 。
(6)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发浓缩、冷却结晶、 、洗涤、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F. 坩埚
(7)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是 (8)能表明I-的还原性弱于SO2的现象是 。
查看习题详情和答案>>
(18分)实验室常用下列装置制备、收集二氧化氮气体,并探究其性质。
(1)装置A中的分液漏斗里盛装的液体通常是 ,圆底烧瓶中预先加入的是铜片,但铁的价格比铜的价格低,此处用铜片不用铁片的原因是 。
(2)干燥管D中装的干燥剂是无水氯化钙,其作用是 。
(3)随着时间的推移,浓硝酸逐渐变稀,装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式如下:2NO2+2NaOH=NaNO3+NaNO2+H2O ;NO2+NO+2NaOH=2NaNO2+H2O
①NO和NO2混合气体的组成可表示成NOx,该混合气体通入NaOH溶液被完全吸收时,x的值可以为 (填字母)
| A.1.1 | B.1.2 | C.1.5 | D.1.8 |
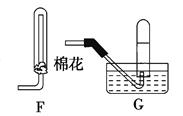
(4)在上述装置中,若改用其它收集装置,最后收集到的气体中无NO2气体,则采用的收集装置是 (选填“F”或 “G”)。
 查看习题详情和答案>>
查看习题详情和答案>>
高中阶段常用化学反应方程式
- 钠在空气中燃烧(黄色的火焰)
- 钠与水反应(浮、熔、游、响、红)
- 过氧化钠与水的反应
- 过氧化钠与二氧化碳的反应
- 苏打(纯碱)与盐酸反应
- 小苏打受热分解
- *固体氢氧化钠、碳酸氢钠混合物在密闭容器中加热
- 金属锂在空气中燃烧
- 铜丝在氯气中剧烈燃烧(棕色烟)
- 铁在氯气中剧烈燃烧
- 氢气在氯气中燃烧(苍白色火焰,瓶口白雾)
- 氯气溶于水及新制氯水的成分:
- 次氯酸见光分解(强氧化剂、杀菌消毒、漂白剂)
- 工业制漂白粉原理
- 氯气实验室制法(主仪器:分液漏斗、圆底烧瓶等)
- 新制氯水注入盛溴化钠溶液的试管中
- 用电子式表示溴化镁、氯化氢分子的形成
- 铁与硫加热反应
- 硫化氢充分燃烧
- 硫化氢不完全燃烧
- 硫化亚铁与稀盐酸反应
- 二氧化硫制三氧化硫(无色固体,熔点16.8℃,44.8℃)
- 浓硫酸与铜反应
- 浓硫酸与非金属碳的反应
- 工业制单质硅(碳在高温下还原二氧化硅)
- 二氧化硅与氢氧化钠反应
- 氮气和氢气反应
- 氮气与氧气放电条件下反应
- 二氧化氮溶于水
- NO2、O2混合气通入水中无剩余气体
- 一定量的NO、O2混合通入水中无剩余气体
- 五氧化二磷与热水反应
- 磷在氯气中充分燃烧
- 氨的催化氧化
- 碳酸氢铵受热分解
- 用浓盐酸检验氨气(白烟生成)
- 硫酸铵溶液与氢氧化钠溶液混合加热
- 硝酸铵溶液与氢氧化钠溶液混合(不加热)
- 铝箔在氧气中剧烈燃烧
- 铝片与稀盐酸反应
- 铝与氢氧化钠溶液反应
- 铝与三氧化二铁高温下反应(铝热反应)
- 镁在二氧化碳中燃
- 氧化铝溶于氢氧化钠溶液
- 硫酸铝溶液中滴过量氨水
- 氢氧化铝溶液中加盐酸
- *高温下铁与水反应
- 铁与盐酸反应
- 氧化铁溶于盐酸中
- 化铁中滴入氢氧化钠溶液(红褐色沉淀)
- 氢氧化亚铁在空气中氧化
- 氯化亚铁溶液中通入氯气
- 氯化铁溶液中加入铁粉
- 甲烷与氯气取代生成四氯化碳
- 乙烯实验室制法(浓硫酸作催化剂,脱水剂)
- 乙烯通入溴水中
- 制取聚乙烯、聚丙烯
- 乙制取
- 由乙炔制聚乙烯
- 与液溴反应(需铁作催化剂)
- 苯的硝化反应
- 与氢气加成生成环己烷
- 甲苯发生硝化反应
- 乙烷水解
- 乙烷消去反应
- 醇与钠反应
- 乙醇催化氧化
- 苯酚与氢氧化钠溶液反应
- 苯酚钠溶液中通入二氧化碳
- 苯酚的定性检验定量测定方法:
- 醛制1-丙醇
- 醛制乙酸
- 乙醛的银镜反应
- 醛与新制氢氧化铜悬浊液
- *乙酸与氢氧化铜悬浊液
- 酸乙酯制取(用饱和碳酸钠溶液收集)
- 葡萄糖结构简式
- 蔗水解方程式
- 淀粉水解
- 硬脂酸甘油酯皂化反应