摘要:(1)SO32-.S2-.CO32- (2) SO42- (3)SO42-.SO32-.CO32- (4)SO42-.SO32-.Cl-三种中至少有一种
网址:http://m.1010jiajiao.com/timu_id_3960929[举报]
 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在右表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
(1)A、B、D、E四种元素分别与M元素形成的简单化合物中,沸点最高的是
H2O
H2O
(填化学式).(2)M、D、E、N形成的简单离子的半径由大到小的关系是(写离子符号)
S2->O2->Na+>H+
S2->O2->Na+>H+
.(3)A、B、D、M可组成多种18电子分子,请写出1种具有18电子的有机物的分子式
CH3OH
CH3OH
.(4)由A、D、N三种元素组成的无机物,其水溶液呈碱性,用离子方程式表示其原因
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.(5)元素B的氢化物与元素D单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为
3:4
3:4
.(6)在由M、D、N、E四种元素构成的化合物的水溶液中滴入少量的Ba(OH)2溶液,写出可能发生的所有反应的离子方程式
2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O或2HSO3-+2OH-+Ba2+═BaSO3↓+2H2O+SO32-
2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O或2HSO3-+2OH-+Ba2+═BaSO3↓+2H2O+SO32-
.已知:H2A的A2-可表示S2-、SO42—、SO32—、SiO32—或CO32—。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空: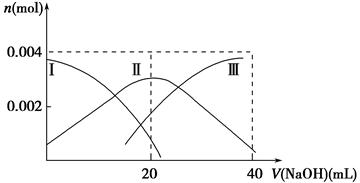
①当V(NaOH)=20 mL时,溶液中离子浓度大小关系:________。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入_______________________________________________________。
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)=Na2S(s)+2O2(g) ΔH1=+1 011.0 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
则反应③Na2SO4(s)+4C(s)=Na2S(s)+4CO(g) ΔH3=________ kJ·mol-1。工业上制备Na2S时往往还要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热,维持反应③所需温度;其二是________________________________________。
(3)若H2A为硫酸:t ℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=________。
若检验某溶液中是否存在下列离子:SO32-、SO42-、CO32-、S2-、Cl-、Br-、I-,根据下列事实分别做出适当结论:
(1)若溶液呈强酸性,不能大量存在的离子是 .
(2)先加盐酸酸化,再加BaCl2溶液,无沉淀产生,则不存在的离子是 .
(3)加入氯水后溶液仍为无色透明,不存在的离子是 .
查看习题详情和答案>>
(1)若溶液呈强酸性,不能大量存在的离子是
(2)先加盐酸酸化,再加BaCl2溶液,无沉淀产生,则不存在的离子是
(3)加入氯水后溶液仍为无色透明,不存在的离子是