摘要:17.已知A.B.C.D是中学化学中常见的四种不同多核粒子.它们之间存在如下关系: (1)如果A.B.C.D均是10电子的粒子.且X为OH-.请写出:A的结构式 .D的电子式 . (2)如果A和C是18电子的粒子.B和D是10电子的粒子.且X为H+.请写出: ①A与B在溶液中反应的离子方程式 . ②根据上述离子方程式.可以判断C与B结合质子的能力大小是(用化学式或离子符号表示): > . (3)已知肼(H2N-NH2)和甲胺(H3C-NH2)都是含18个电子的分子.分析肼和甲胺的结构特点并从中受到启发.写出与其具有相同电子数的有机化合物的结构简式: . [解析] (1)能与OH-反应的多核10电子微粒主要有NH4+.H3O+.HF等.而HF一旦与OH-反应后生成的F-就是单核微粒了.结合A.B.C.D之间的反应关系可知:A为NH3.B为H3O+.C为NH4+.D为H2O. (2)18电子多核微粒在酸性条件下转化的有:H2S和HS-.故A为H2S.C为HS-.B为OH-.D为H2O.OH-可夺取H2S中的H+.可见吸H+能力:OH->HS-. (3)9电子自由基有:-F.-OH.-CH3.-NH2等.两两组合形成的分子均含18个电子. [答案] (2)①H2S+OH-===HS-+H2O ②OH- HS- (3)CH3-CH3(或CH3-OH)
网址:http://m.1010jiajiao.com/timu_id_3960148[举报]
 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.(1)如果A、B是10电子离子,C、D是10电子分子,A、B、C、D均含有两种元素.请写出A、B的电子式:A




NH3
NH3
、DH2O
H2O
.(2)写出A离子与B反应的离子方程式:
OH-+NH4+=NH3↑+H2O
OH-+NH4+=NH3↑+H2O
. 已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:
已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:①A的电子式是


②加热条件下A与B在溶液中反应的离子方程式
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
| ||
③C中含有的化学键类型为:
共价键
共价键
④铝可以与B的某溶液反应,写出此反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.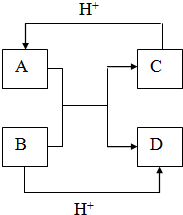 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.(1)如果A、B是10电子离子,C、D是10电子分子,A、B、C、D均含有两种元素.请写出A、B、C、D四种不同微粒的化学式:A
(2)写出A离子与B反应的离子方程式:
(3)如果A、C是18电子的阴离子,A带一个单位负电苛,C带两个单位负电苛,B、D是10电子微粒,A、B、D均含有两种元素.请写出A和B在溶液中反应的离子方程式:

