摘要:6.16.a g铁粉与含有H2SO4的CuSO4溶液完全反应后.得到a g铜.则参与反应的CuSO4与H2SO4 的物质的量之比为( ) A.1 :7 B.7 :1 C.7 :8 D.8 :7
网址:http://m.1010jiajiao.com/timu_id_3959872[举报]
下列叙述中完全正确的一组是
①常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③5.6克铁粉与硝酸反应失去的电子一定是0.3NA
④常温常压下,16 g O2和O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31 NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2 NA
⑦标准状况下,22.4 L水中含分子数为NA
A.②③④ B.②③⑥⑦ C.①②④⑤ D.②③④⑤
查看习题详情和答案>>
下列叙述中完全正确的一组是
①常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③5.6克铁粉与硝酸反应失去的电子一定是0.3NA
④常温常压下,16 g O2和O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31 NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2 NA
⑦标准状况下,22.4 L水中含分子数为NA
A.②③④ B.②③⑥⑦ C.①②④⑤ D.②③④⑤
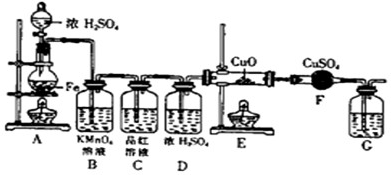
查看习题详情和答案>>某同学设计下图装置进行铁和浓H2SO4反应的实验探究,请回答下列问题.
(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H2SO4,结果没有任何反应现象,原因是
(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅(产物中有Mn2+),请用离子方程式表示:
(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是
(4)反应一段时间后,E、F处可观察到明显的现象,F处的实验现象
(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是
A.CaCl2溶液 B.Ca(OH)2溶液 C.浓硫酸 D.CCl4
(6)将a mol Fe与含b mol H2SO4的浓硫酸共热,假设按本题的过程进行反应,如果Fe与H2SO4均恰好完全反应,则生成的有
气体1是
气体2是
查看习题详情和答案>>

(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H2SO4,结果没有任何反应现象,原因是
铁在冷的浓硫酸中钝化
铁在冷的浓硫酸中钝化
.随后点燃A处酒精灯,就有气体产生了.(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅(产物中有Mn2+),请用离子方程式表示:
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
,C中品红溶液颜色始终没有变化.(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是
待反应产生的H2将装置中的空气排尽再加热,防止H2与空气混合加热爆炸
待反应产生的H2将装置中的空气排尽再加热,防止H2与空气混合加热爆炸
.(4)反应一段时间后,E、F处可观察到明显的现象,F处的实验现象
白色粉末变为蓝色
白色粉末变为蓝色
.(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是
CD
CD
A.CaCl2溶液 B.Ca(OH)2溶液 C.浓硫酸 D.CCl4
(6)将a mol Fe与含b mol H2SO4的浓硫酸共热,假设按本题的过程进行反应,如果Fe与H2SO4均恰好完全反应,则生成的有
气体1是
H2
H2
,其物质的量为(2a-b)
(2a-b)
mol,气体2是
SO2
SO2
,其物质的量为(b-a)
(b-a)
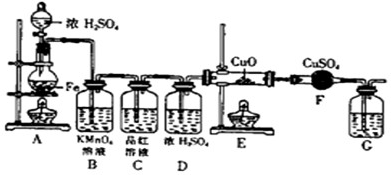
mol.某同学设计下图装置进行铁和浓H2SO4反应的实验探究,请回答下列问题.
(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H2SO4,结果没有任何反应现象,原因是______.随后点燃A处酒精灯,就有气体产生了.
(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅(产物中有Mn2+),请用离子方程式表示:______,C中品红溶液颜色始终没有变化.
(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是______.
(4)反应一段时间后,E、F处可观察到明显的现象,F处的实验现象______.
(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是______
A.CaCl2溶液 B.Ca(OH)2溶液 C.浓硫酸 D.CCl4
(6)将a mol Fe与含b mol H2SO4的浓硫酸共热,假设按本题的过程进行反应,如果Fe与H2SO4均恰好完全反应,则生成的有
气体1是______,其物质的量为______mol,
气体2是______,其物质的量为______mol.
查看习题详情和答案>>

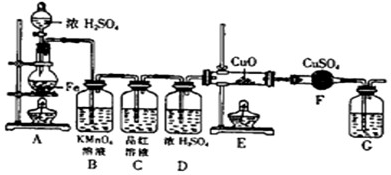
(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H2SO4,结果没有任何反应现象,原因是______.随后点燃A处酒精灯,就有气体产生了.
(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅(产物中有Mn2+),请用离子方程式表示:______,C中品红溶液颜色始终没有变化.
(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是______.
(4)反应一段时间后,E、F处可观察到明显的现象,F处的实验现象______.
(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是______
A.CaCl2溶液 B.Ca(OH)2溶液 C.浓硫酸 D.CCl4
(6)将a mol Fe与含b mol H2SO4的浓硫酸共热,假设按本题的过程进行反应,如果Fe与H2SO4均恰好完全反应,则生成的有
气体1是______,其物质的量为______mol,
气体2是______,其物质的量为______mol.