摘要:2Fe 2++H2O2+ 2H+══2Fe 3++2 H2O
网址:http://m.1010jiajiao.com/timu_id_3956951[举报]
现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A)
(2)如果(A或B)不能,说明其原因
(3)如果(A或B)可以,则画出装装置图并写出正、负极的电极反应式
负极:
正极:
查看习题详情和答案>>
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A)
不能
不能
(B)能
能
(2)如果(A或B)不能,说明其原因
(A)的反应非氧化还原反应,没有电子转移
(A)的反应非氧化还原反应,没有电子转移
(3)如果(A或B)可以,则画出装装置图并写出正、负极的电极反应式
负极:
Cu-2e-=Cu 2+.
Cu-2e-=Cu 2+.
正极:
2Fe 3++2e-=2Fe 2+
2Fe 3++2e-=2Fe 2+
.钢铁工业是国家工业的基础,请回答钢铁腐蚀、防护过程中的有关问题.
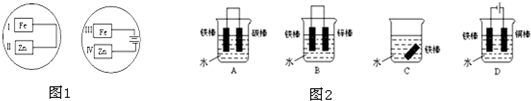
(1)若把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图1所示,能观察到酚酞变红的现象的区域是
(2)如图2所示各个装置中铁棒被腐蚀由易到难的顺序是
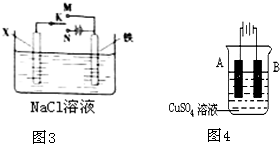
(3)利用如图3装置,可模拟铁的电化学防护,下列有关说法正确的是
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为锌板,K置于M或N处,均能减缓铁的腐蚀
C.若X为碳棒,K置于M或N处,一段时间后溶液pH均不变
D.若X为碳棒,K置于M或N处,Cl-均向X电极移动
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图4,请回答:
①B电极对应的金属是
②若电镀前铁、铜两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差
查看习题详情和答案>>

(1)若把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图1所示,能观察到酚酞变红的现象的区域是
Ⅰ、Ⅳ
Ⅰ、Ⅳ
(填I、II、III、IV),写出II处电极的电极反应式:Zn-2e-=Zn2+
Zn-2e-=Zn2+
;写出IV处电极的电极反应式:2H++2e-=H2↑
2H++2e-=H2↑
;写出该两种情况下发生的总反应的离子方程式:2Fe+O2+H2O=2Fe(OH)2
2Fe+O2+H2O=2Fe(OH)2
;Fe+2H2O
Fe(OH)2+H2↑
| ||
Fe+2H2O
Fe(OH)2+H2↑
.若把III的铁片改为碳棒,写出该处发生的电极反应式:
| ||
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
(2)如图2所示各个装置中铁棒被腐蚀由易到难的顺序是
ACBD
ACBD
(填字母)
(3)利用如图3装置,可模拟铁的电化学防护,下列有关说法正确的是
AB
AB
(填字母)A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为锌板,K置于M或N处,均能减缓铁的腐蚀
C.若X为碳棒,K置于M或N处,一段时间后溶液pH均不变
D.若X为碳棒,K置于M或N处,Cl-均向X电极移动
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图4,请回答:
①B电极对应的金属是
铁
铁
(写元素名称),A电极的电极反应式是Cu-2e-=Cu2+
Cu-2e-=Cu2+
②若电镀前铁、铜两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差
12.8
12.8
g.某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作 I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有
A.50mL烧杯 B.50mL量筒 C.25mL碱式滴定管 D.25mL酸式滴定管
(2)加入试剂①和②后发生反应的离子反应方程式为:
(3)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是:
×100%
×100%.
(5)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是:
查看习题详情和答案>>

请根据上面流程,回答以下问题:
(1)操作 I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有
250mL容量瓶、胶头滴管
250mL容量瓶、胶头滴管
(填自选仪器名称),操作 II 必须用到的仪器是D
D
(从以下选项中选择,填编号).A.50mL烧杯 B.50mL量筒 C.25mL碱式滴定管 D.25mL酸式滴定管
(2)加入试剂①和②后发生反应的离子反应方程式为:
2Fe 2++Cl2=2Fe 3++2Cl-、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
2Fe 2++Cl2=2Fe 3++2Cl-、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
(3)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是
再次加热,并置于干燥器中冷却,称量,直至连续两次质量差不超过0.1g为止
再次加热,并置于干燥器中冷却,称量,直至连续两次质量差不超过0.1g为止
.(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是:
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
(5)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是:
4Fe(OH)2+2H2O+O2=4Fe(OH)3
4Fe(OH)2+2H2O+O2=4Fe(OH)3
(用化学方程式表示)