摘要:3Cl2+2Fe 2++4I- 2Fe3++2I2
网址:http://m.1010jiajiao.com/timu_id_3956904[举报]
(2011?上海)电解饱和食盐水的反应为2NaCl+2H2O
Cl2↑+H2↑+2NaOH.
(1)在上述方程式上标出电子转移的方向和数目
 .
.
(2)该反应中被氧化的元素是
(3)电解产物氯气既能作氧化剂,也能作还原剂.下列反应中氯气只作氧化剂的是
a.Cl2+2KI→2KCl+I2 b.Cl2+2NaOH→NaCl+NaClO+H2O
c.CuCl2
Cl2↑+Cu d.3Cl2+2Fe
2FeCl3.
查看习题详情和答案>>
| 通直流电 |
(1)在上述方程式上标出电子转移的方向和数目


(2)该反应中被氧化的元素是
Cl
Cl
.阴极产物之一为H2,阴极上发生的变化为还原
还原
反应(选填“氧化”、“还原”).(3)电解产物氯气既能作氧化剂,也能作还原剂.下列反应中氯气只作氧化剂的是
ad
ad
(填写编号).a.Cl2+2KI→2KCl+I2 b.Cl2+2NaOH→NaCl+NaClO+H2O
c.CuCl2
| 通直流电 |
| 点燃 |
 (2008?江苏)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
(2008?江苏)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:
Cu+H2O2+H2SO4═CuSO4+2H2O
Cu+H2O2+H2SO4═CuSO4+2H2O
.(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色.写出与上述变化过程相关的离子方程式:
4Fe2++O2+4H+═4Fe3++2H2O
4Fe2++O2+4H+═4Fe3++2H2O
、2Fe3++2I-═2Fe2++I2
2Fe3++2I-═2Fe2++I2
.(3)写出Cl2将Z氧化为K2EO4的化学方程式:
10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O
10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O
.(4)由E制备的E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为:
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有1
1
种峰(即有几种化学环境完全相同H原子),错误的结构有3
3
种峰.实验室用如图所示的仪器药品制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶水化合物FeCl3+6H2O=FeCl3?6H2O,
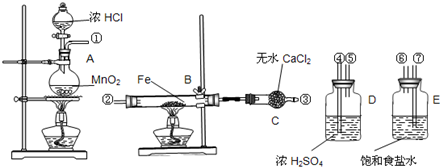
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序)①接
(2)烧瓶A中反应的离子方程式是
(3)容器D的作用是
(4)A、B中的酒精灯应先点燃
(5)这套实验装置是否完整?
查看习题详情和答案>>

(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序)①接
⑦
⑦
,⑥
⑥
接④
④
,⑤
⑤
接②
②
(2)烧瓶A中反应的离子方程式是
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
,B中反应的化学方程式是
| ||
3Cl2+2Fe
2FeCl3
| ||
3Cl2+2Fe
2FeCl3
| ||
(3)容器D的作用是
吸收水分
吸收水分
,容器E的作用是吸收氯气中的氯化氢气体
吸收氯气中的氯化氢气体
(4)A、B中的酒精灯应先点燃
A
A
处(填“A”或“B”)的酒精灯,理由是使制取的Cl2排尽装置内的空气,防止铁被空气中氧气氧化
使制取的Cl2排尽装置内的空气,防止铁被空气中氧气氧化
(5)这套实验装置是否完整?
否
否
(填“是”或“否”),若不完整还须补充装有氢氧化钠溶液的烧杯或尾气吸收
装有氢氧化钠溶液的烧杯或尾气吸收
装置(若第一问填“是”,则此问不需要作答)下图中,A、D为气体非金属单质,N、P是金属单质;M为红褐色沉淀;B、E为有刺激性气味的气体;通常状况下,Z为液体;C是由三咱短周期非金属元素组成的离子化合物;I、L为白色沉淀.反应②、⑥均可用于实验室制取某种常见气体;工业上以D为原料生产B(图中部分反应物和生成物没有列出).
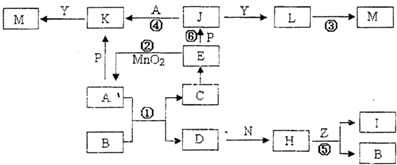
请按要求回答:
(1)写出D的结构式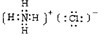
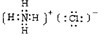 ;H的电子式
;H的电子式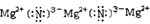
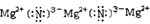 .
.
(2)上述①--⑥反应中属于氧化还原反应的有
用于除去K溶液中含有的少量J(填写序号).
(3)反应②的离子方程式为了
实验室制B的化学方程式为
(4)生活中K可用作净水剂,用离子方程式表示其原理
(5)写出A、M和氢氧化钾在一定条件下反应生成K2PO4(P为题中P物质的元素符号,答题时用所对应的元素符号表示)
查看习题详情和答案>>

请按要求回答:
(1)写出D的结构式
N≡N
N≡N
,C的电子式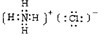
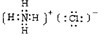
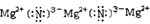
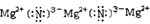
(2)上述①--⑥反应中属于氧化还原反应的有
①②③④⑥
①②③④⑥
(填写序号),其中反应④
④
可用于除去K溶液中含有的少量J(填写序号).
(3)反应②的离子方程式为了
4H++MnO2
Cl2↑+Mn2++2H2O
| ||
4H++MnO2
Cl2↑+Mn2++2H2O
.
| ||
实验室制B的化学方程式为
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
| ||
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
.
| ||
(4)生活中K可用作净水剂,用离子方程式表示其原理
Fe3++3H2O
Fe(OH)3(胶体)+3H+
| ||
Fe3++3H2O
Fe(OH)3(胶体)+3H+
.
| ||
(5)写出A、M和氢氧化钾在一定条件下反应生成K2PO4(P为题中P物质的元素符号,答题时用所对应的元素符号表示)
3Cl2+2Fe(OH)3+10KOH
2K2FeO4+6KCl
| ||
3Cl2+2Fe(OH)3+10KOH
2K2FeO4+6KCl
.
| ||
一定量Fe跟HCl 溶液反应得到溶液A,一定量Fe与Cl2在一定条件反应得到产物B溶于水配成溶液,分装在A,B二支试管中.请回答:
(1)得到A的离子方程式
(2)向B试管中加入足量铁粉,反应的离子方程式为
查看习题详情和答案>>
(1)得到A的离子方程式
Fe+2H+═Fe2++H2↑
Fe+2H+═Fe2++H2↑
得到B的化学方程式2Fe+3Cl2
2FeCl3
| ||
2Fe+3Cl2
2FeCl3
| ||
(2)向B试管中加入足量铁粉,反应的离子方程式为
2Fe3++Fe═3Fe2+
2Fe3++Fe═3Fe2+
;向反应后所得溶液中滴加NaOH溶液并放置一段时间,反应中的实验现象为白色沉淀迅速变为灰绿色最后变为红褐色
白色沉淀迅速变为灰绿色最后变为红褐色
,此过程中的氧化还原反应方程式4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.