摘要:1mol所给物质在与Na . NaOH . NaHCO3.Br2.H2等分别反应时.最多消耗Na NaOH NaHCO3.Br2.H2的物质的量为多少.
网址:http://m.1010jiajiao.com/timu_id_3950924[举报]
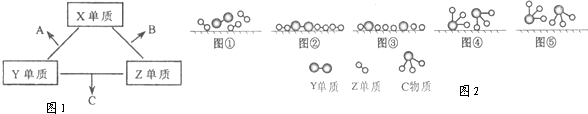
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图1变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是 周期, 族.
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们 .
(3)C的电子式是 ; Z单质与Y单质在固体催化剂表面合成C的反应过程,示意如图2.
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是 .
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K= ;用物质C表示该反应的反应速率为 .
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式 .用该反应合成1mol液态甲醇吸收热量131.9kJ,
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式 .
查看习题详情和答案>>

(1)X元素在周期表中的位置是
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们
(3)C的电子式是
图①至⑤中表示在催化剂表面Z单质与Y单质中化学键断裂是
(4)在一定条件下,1L密闭容器中充入1mol Y单质和3mol Z单质进行反应,经过20min达到平衡时,Y单质的物质的量为0.8mol,用题中所给数据列出平衡常数表达式(不必计算结果),K=
(5)为幵发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.写出由CO和Z单质在一定条件下生成甲醇的化学方程式
又知:4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kL/mol
H2O(g)=H2O(l)△H=-44.0kL/mol
请写出表达液态甲醇燃烧热的热化学方程式
某化学实验兴趣小组在“探究氯水与溴化亚铁溶液反应”的实验中发现:“在足量的溴化亚铁溶液中,加入1~2滴氯水,振荡后溶液呈黄色.”
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
溶液呈黄色是因发生离子反应①
溶液呈黄色是因发生离子反应②
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br-
(4)实验反思
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是
Ⅱ.在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
查看习题详情和答案>>
| [资料] | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色. |
(1)提出问题猜想:
溶液呈黄色是因发生离子反应①
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
( 填离子方程式)所致.溶液呈黄色是因发生离子反应②
2Br-+Cl2=Br2+2Cl-
2Br-+Cl2=Br2+2Cl-
( 填离子方程式)所致.(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加 KSCN溶液 KSCN溶液 并振荡 |
溶液变红色 | 反应 ① ① 所致 |
| 2 | 取所述黄色溶液于试管中,滴加 CCl4 CCl4 并振荡 |
----------- | |
强
强
(填“强”或“弱”).(4)实验反思
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是
溶液分上下两层,上层为黄色、下层为橙红色
溶液分上下两层,上层为黄色、下层为橙红色
.Ⅱ.在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为
1mol/L
1mol/L
.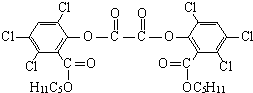 “魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯
“魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯(CPPO)结构简式如右图所示,请回答下列问题:
(1)草酸(乙二酸)的结构简式为
(2)关于CPPO以下说法正确的是
A.草酸二酯是芳香化合物
B.1mol草酸二酯最多可与4mol NaOH反应
C.1mol草酸二酯在铂催化下最多可与6mol H2加成
D.草酸二酯的分子式为C26H23O8Cl6
(3)草酸、戊醇和芳香化合物M (
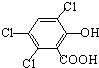 )在催化剂和适当条件下可以生成CPPO,则:
)在催化剂和适当条件下可以生成CPPO,则:①生成CPPO的反应类型为
②戊醇的醇类的同分异构体有
③芳香化合物M可以由物质N氧化得到.已知苯酚和甲醛可以发生反应:
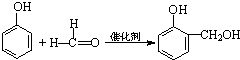 ,
, 与(CH3)2C=CH2也可以发生类似的反应生成N,则N结构简式为
与(CH3)2C=CH2也可以发生类似的反应生成N,则N结构简式为根据题目所给信息判断各物质的结构,按要求回答问题.
(1)某苯的同系物的分子式为 C9H12的核磁共振氢谱只有两个吸收峰,该分子的结构简式为
 .
.
(2)当0.1mol 烃 A 在氧气中完全燃烧时生成CO2和H2O各0.6mol,催化加氢后生成2,2-二甲基丁烷,则A的结构式为
(3)根据所给信息,写出分子式为C6H12的某烯烃的结构简式:
①若该烯烃不存在顺反异构,则可能的结构简式( 要求写出两种)
②若该烯烃与氢气加成后得到的烷烃分子中含4个甲基,写出该烷烃所有可能的结构简式:
查看习题详情和答案>>
(1)某苯的同系物的分子式为 C9H12的核磁共振氢谱只有两个吸收峰,该分子的结构简式为


(2)当0.1mol 烃 A 在氧气中完全燃烧时生成CO2和H2O各0.6mol,催化加氢后生成2,2-二甲基丁烷,则A的结构式为
(CH3)3CCH=CH2
(CH3)3CCH=CH2
.(3)根据所给信息,写出分子式为C6H12的某烯烃的结构简式:
①若该烯烃不存在顺反异构,则可能的结构简式( 要求写出两种)
CH3CH2CH=C(CH3)2
CH3CH2CH=C(CH3)2
、(CH3)2C=C(CH3)2
(CH3)2C=C(CH3)2
.②若该烯烃与氢气加成后得到的烷烃分子中含4个甲基,写出该烷烃所有可能的结构简式:
(CH3)2CHCH(CH3)2;(CH3)3CCH2CH3
(CH3)2CHCH(CH3)2;(CH3)3CCH2CH3
.
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,写出该反应的化学方程式并配平 .若反应过程中转移了0.3mol电子,则氧化产物的质量是 g.
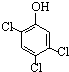
(2)同一物质呈气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质.所查资料如下:
a.碲(Te)为固体,H2Te为气体,Te和H2不能直接化合成H2Te
b.等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图1所示:
请回答下列问题:
H2与硫化合的反应 热量(填“放出”或“吸收”).根据题目所给信息,请解释为什么Te和H2不能直接化合 .
(3)在复杂的反应中,要考虑反应的先后顺序.已知N
+Al
+2H2O═Al(OH)3↓+NH3?H2O,向含有等物质的量的N
、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中:
第二个离子反应的离子方程式是 .
最后一个离子反应的离子方程式是 .
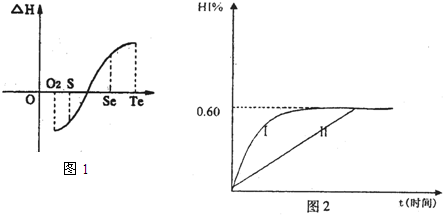
(4)将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:
H2(g)+I2(g)?2HI(g),△H<0.并达平衡.HI的体积分数HI%随时问变化曲线如图2所示:
①达到平衡时,I2(g)的物质的量浓度为 mol/L.
②保持加入的反应物的物质的量不变,若改变反应条件,在某一条件下HI%的变化如曲线1所示,则该条件可能是(写出所有的可能性) 在这种条件下,平衡常数K值 (填“增大”、“变小”、“不变”或“可能变大也可能变小”)
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol HI(g),发生反应达到平衡时,H2的体积分数为 .
查看习题详情和答案>>

(2)同一物质呈气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质.所查资料如下:
a.碲(Te)为固体,H2Te为气体,Te和H2不能直接化合成H2Te
b.等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图1所示:
请回答下列问题:
H2与硫化合的反应
(3)在复杂的反应中,要考虑反应的先后顺序.已知N
| H | + 4 |
| O | - 2 |
| H | + 4 |
第二个离子反应的离子方程式是
最后一个离子反应的离子方程式是
(4)将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:
H2(g)+I2(g)?2HI(g),△H<0.并达平衡.HI的体积分数HI%随时问变化曲线如图2所示:
①达到平衡时,I2(g)的物质的量浓度为
②保持加入的反应物的物质的量不变,若改变反应条件,在某一条件下HI%的变化如曲线1所示,则该条件可能是(写出所有的可能性)
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol HI(g),发生反应达到平衡时,H2的体积分数为