摘要:22.(1)恒温.恒容条件下.反应:2NO2N2O4达平衡后.再加入NO2.平衡向 方向移动,达新平衡后.c (NO2)/c (N2O4)与原平衡相比.怎样变化 ?NO2 的体积分数怎样变化? N2O4 的体积分数怎样变化? 若最初加的是NO2.则NO2的转化率增大还是减小? (2)恒温.恒容条件下.反应:2NO2N2O4达平衡后.再加入N2O4.平衡向 方向移动,达新平衡后.c(NO2)/c(N2O4)与原平衡相比.怎样变化?
网址:http://m.1010jiajiao.com/timu_id_3948884[举报]
 (2011?郑州二模)利用所学化学反应原理,解决以下问题:
(2011?郑州二模)利用所学化学反应原理,解决以下问题:(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、N
| H | + 4 |
| H | + 4 |
NH4Cl和NH3?H2O
NH4Cl和NH3?H2O
.(2)0.1mol?L-1的氨水与0.05mol?L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:
NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是
R2Z>RX>RY
R2Z>RX>RY
.(4)以石墨电极电解100mL 0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为
0.64
0.64
g.(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=
0.2
0.2
mol?L-1.(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+
I2(g)?2HI(g)△H=-14.9kJ?mol-1),在恒温、恒容条件下,测得反应达
到平衡时的数据如下表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2、1mol I2 | 2 mol HI | 4 mol HI |
| HI的浓度(mol?L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 反应物转化率 | a1 | a2 | a3 |
AC
AC
.A.α1+α2=1 B.2α2=α3 C.a+b=14.9 D.c1=c2=c3.
在温度,容积相同的3个密闭容器中,按不同方式投入反应物,在保持恒温、恒容条件下发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,测得相关数据如下表:
|
查看习题详情和答案>>
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.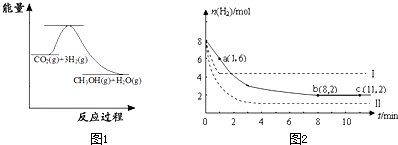
(1)目前工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.该反应是
(2)某温度下,若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2实线所示(图中字母后的数字表示对应的坐标).
①在反应进行的0~1min内,该反应的平均速率v(H2)=
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),平衡将向着能够减弱这种改变的方向移动.若上述反应体系不改变反应物的物质的量,仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是
(3)下列各项中,不能够说明CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C.一定条件下,H2O(g)的浓度保持不变
D.一定条件下,单位时间内消耗1mol CO2,同时生成1mol CH3OH.
查看习题详情和答案>>

(1)目前工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.该反应是
放热
放热
(填“吸热”或“放热”)反应.(2)某温度下,若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2实线所示(图中字母后的数字表示对应的坐标).
①在反应进行的0~1min内,该反应的平均速率v(H2)=
1mol/(L?min)
1mol/(L?min)
②如果改变影响化学平衡的一个因素(如:温度、浓度、压强),平衡将向着能够减弱这种改变的方向移动.若上述反应体系不改变反应物的物质的量,仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I改变的实验条件是
升高温度
升高温度
,曲线Ⅱ改变的实验条件是增大压强
增大压强
.(3)下列各项中,不能够说明CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是
D
D
(填选项).A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C.一定条件下,H2O(g)的浓度保持不变
D.一定条件下,单位时间内消耗1mol CO2,同时生成1mol CH3OH.
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)??CH3OH(g).

(1)分析该反应并回答下列问题:
①平衡常数表达式为K=
.
②下列各项中,不能够说明该反应已达到平衡的是
A、恒温、恒容条件下,容器内的压强不发生变化
B、一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C、一定条件下,CO、H2和CH3OH的浓度保持不变
D、一定条件下,单位时间内消耗2mol CO,同时生成1mol CH3OH
(2)如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
①该反应的焓变△H
②T1和T2温度下的平衡常数大小关系是K1
③若容器容积不变,下列措施可增加甲醇产率的是
A、升高温度
B、将CH3OH(g)从体系中分离
C、使用合适的催化剂
D、充入He,使体系总压强增大
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图2所示.
①该电池工作时,b口通入的物质为
②该电池正极的电极反应式为:
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,有
查看习题详情和答案>>

(1)分析该反应并回答下列问题:
①平衡常数表达式为K=
| c(CH3OH) |
| c(CO)?c(H2)2 |
| c(CH3OH) |
| c(CO)?c(H2)2 |
②下列各项中,不能够说明该反应已达到平衡的是
D
D
(填序号).A、恒温、恒容条件下,容器内的压强不发生变化
B、一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
C、一定条件下,CO、H2和CH3OH的浓度保持不变
D、一定条件下,单位时间内消耗2mol CO,同时生成1mol CH3OH
(2)如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
①该反应的焓变△H
<
<
0(填“>”、“<”或“=”).②T1和T2温度下的平衡常数大小关系是K1
>
>
K2(填“>”、“<”或“=”).③若容器容积不变,下列措施可增加甲醇产率的是
B
B
.A、升高温度
B、将CH3OH(g)从体系中分离
C、使用合适的催化剂
D、充入He,使体系总压强增大
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图2所示.
①该电池工作时,b口通入的物质为
CH3OH
CH3OH
,c口通入的物质为O2
O2
.②该电池正极的电极反应式为:
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
.③工作一段时间后,当6.4g甲醇完全反应生成CO2时,有
1.2
1.2
NA个电子转移.