网址:http://m.1010jiajiao.com/timu_id_3944640[举报]

(1)“焙烧1”通入空气的目的是
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:
(3)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室中检测溶液pH的简单方法是
(4)写出“焙烧2”发生反应的化学方程式:
(5)Pd中加入王水的反应可以表示为Pd+HCl+HNO3-→A+B↑+H2O(未配平).其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%.则A的化学式为
 (2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,△S=+133.7J?(K?mol)-1
①该反应能否自发进行与
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是
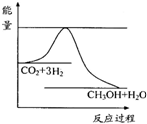
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2.
①在处理产生的废水时,需先加入明矾,其作用是作
②改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量.为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行
(2)我国材料科学家师昌绪在合金钢、高温合金及材料强度的研究领域作出杰出贡献,荣获2010年度国家最高科学技术奖.
①汽车尾气(含有烃类、CO、SO2与NO等物质)治理的方法之一是在汽车的排气管上装一个用铂、钯合金作催化剂的催化转换器.它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的转化.写出CO与NO反应的化学方程式:
| ||
| ||
②钢铁是人们生活中常用的金属材料,也是一种合金.如图所示,钢铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)

(3)经研究,光化学烟雾的有害物质中含有臭氧,其形成过程与二氧化氮有关,这个过程实际上包含了三个反应:
①NO2
| ||
实验1:
①称取一定质量的样品,将样品溶解;②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;③将沉淀过滤、洗涤、干燥得到白色固体28.7g.
实验2:
①称取与实验1中相同质量的样品,溶解;②向溶解后的溶液中通入足量的Cl2;③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;④将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体Fe2O36.40g.
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有
(2)实验室保存FeCl2溶液时通常会向其中加入少量的铁粉,其作用是(用方程式表示)
(3)用化学方程式表示实验2的步骤②中通入足量Cl2的反应:
(4)用容量瓶配制实验所用的NaOH溶液,下列情况会使所配制溶液浓度偏高的是(填序号)
A.未冷却溶液直接转移
B.没用少量蒸馏水洗涤烧杯和玻璃棒2-3次并转入容量瓶
C.加蒸馏水时,不慎超过了刻度线
D.砝码上沾有杂质
E.容量瓶使用前内壁沾有水珠
(5)检验实验2的步骤④中沉淀洗涤干净的方法是
(6)该小组取来的样品中含有FeCl2的质量为
(10分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
 C(s)+H2O(g)
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol)
-1
C(s)+H2O(g)
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol)
-1
①该反应能否自发进行与 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放”)热反应
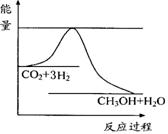
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
查看习题详情和答案>>