摘要:6.元素的性质与元素的原子核外电子排布的关系 (1)稀有气体的不活泼性:稀有气体元素的原子最外层有8个电子.处于稳定结构.因此化学性质稳定.一般不跟其他物质发生化学反应. (2)非金属性与金属性: 最外层电子数 得失电子趋势 元素的性质 金属元素 <4 较易失 金属性 非金属元素 >4 较易得 非金属性 知识拾零
网址:http://m.1010jiajiao.com/timu_id_3942876[举报]
甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为____________________________;
乙单质与丙单质反应的化学方程式为______________________________。
甲元素的原子序数是11,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为__________________________。乙单质与丙单质反应的化学方程式为______________________________________________________。
甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素.由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________.
(2)甲的单质与水反应的离子方程式为________,乙单质与丙单质反应的化学方程式为________.
A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02g H2,用去0.4g A.B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体.
(1)写出两种元素的名称:A
(2)用电子式表示A、B形成的化合物中化学键的形成过程
 .
.
查看习题详情和答案>>
(1)写出两种元素的名称:A
钙
钙
,B溴
溴
.(2)用电子式表示A、B形成的化合物中化学键的形成过程


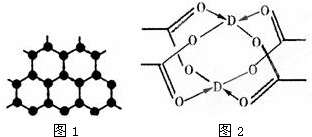 原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:
原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:(1)这四种元素中电负性最大的是
Cl
Cl
(填元素符号)、第一电离能最小的是Cu
Cu
(填元素符号)(2)C所在的主族元素气态氢化物中,沸点最低的是
HCl
HCl
(填化学式)(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图1所示,其原子的杂化类型为
sp2
sp2
;(4)D的水合醋酸盐晶体局部结构如图2,该晶体中含有的化学键是
①②③
①②③
(填选项序号);①极性键 ②非极性键 ③配位键 ④金属键.