摘要:物料平衡 所谓物料平衡即电解质发生电离或水解前某元素的原子的物质的量应等于电解质溶液中所有含该元素的微粒中原子的总的物质的量. [例6].在0.1mol/L的NaHCO3溶液中,下列各关系式正确的是 (. ) A.c(Na+)> c(HCO3-)> c(H +)> c(OH-) B.c(Na+)+c(H +) = c(HCO3-)+ c(OH-)+2c(CO32-) C.c(Na+)= c(HCO3-)> c(OH-)> c(H +) D.c(Na+) = c(HCO3-)+c(CO32-)+ c(H2CO3) [解析]由物料平衡可知HCO3-的初始浓度应该等于电离和水解分别达平衡时各产物及剩余HCO3-的浓度之和.即c(HCO3-)初始 =c(CO32-)+c(HCO3-)c(H2CO3),因c(Na+)= c(HCO3-)初始 ,所以答案D正确.在从电荷平衡的角度知答案B也正确.故本题答案为BD. 排列溶液中微粒浓度的大小顺序专题训练
网址:http://m.1010jiajiao.com/timu_id_3937448[举报]
合成氨的热化学方程式为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.现将1mol N2(g),3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为ω,下列说法中正确的是( )
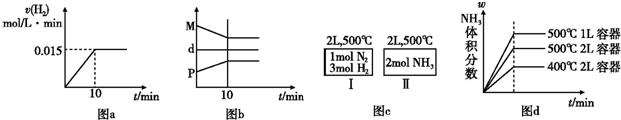

| A、若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示 | B、反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为P,三者关系如图b | C、如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为ω,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ | D、若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示 |
(2010?唐山三模)合成氨反应的热化学方程式为:N2(g)+3H2(g)
2NH3(g);△H=-92.4kJ/mol现将1molN2和3molH2加入到2L的固定密闭容器中,在500℃下进行反应,10min达到平衡,NH3的体积分数为ω.下列说法正确的是( )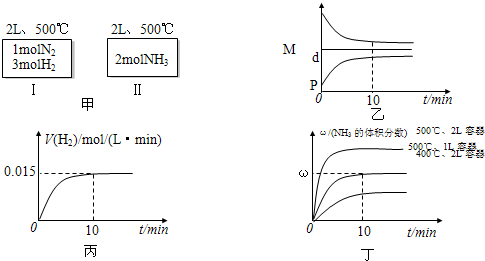
| 高温、高压 |
| 催化剂 |

查看习题详情和答案>>
合成氨反应的热化学方程式为:N2(g)+3H2(g)
2NH3(g);△H=-92.4kJ/mol现将1molN2和3molH2加入到2L的固定密闭容器中,在500℃下进行反应,10min达到平衡,NH3的体积分数为ω.下列说法正确的是( )
查看习题详情和答案>>
| 高温、高压 |
| 催化剂 |

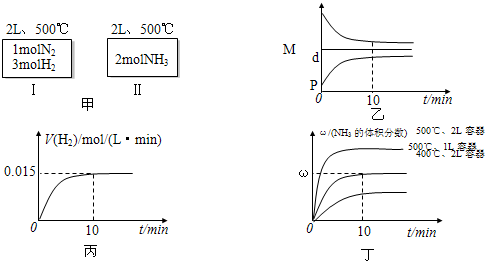
| A.如甲图所示:Ⅰ、Ⅱ两种途径中达到平衡时,NH3的体积分数均为ω,且Ⅰ中放出的热量与Ⅱ中吸收的热量之和为92.4kJ |
| B.反应进程中,混合气体的平均相对分子质量(M)、混合气体的密度(d)、混合气体的压强(P)三者的变化趋势如图乙所示 |
| C.若达到平衡时放出的热量为9.24kJ,则氢气的反应速度变化曲线如图丙所示 |
| D.若起始加入的物料均为1molN2、3molH2,在不同条件下达到平衡时,NH3的体积分数变化曲线如丁图所示 |