摘要:表示阿伏伽德罗常数.下列判断正确的是 A.在18中含有个氧原子 B.标准状况下.22.4L空气含有个单质分子 C.1 molCl2参加反应转移电子数一定为2 D.含个的溶解于1L水中.的物质的量浓度为 解析:本题考察阿弗加德罗常数的计算和判断 A 18正好是0.5mol.一个氧分子正好含有两个氧原子.所以氧原子的物质的量为1mol.即为1 B 空气是混合物 C 在氯气与水的反应中.1molCl2 就只转移1的电子 D 所得溶液中含个.可得氢氧化钠的物质的量为1mol.但这时候溶液不是1L.所以物质的量浓度不是1mol/L. 答案:A
网址:http://m.1010jiajiao.com/timu_id_3932771[举报]
(2010?福建)工业上常用铁质容器盛装冷浓酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应先用
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验状置(图中夹持仪器省略).

(3)装置B中试剂的作用是
(4)认为气体Y中还含有Q的理由是
(5)为确认Q的存在,需在装置中添加M于
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是
(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28ml H2),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由
查看习题详情和答案>>
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
铁钉表面被氧化
铁钉表面被氧化
.(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应先用
d
d
选填序号).a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为
66.7%
66.7%
.[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验状置(图中夹持仪器省略).

(3)装置B中试剂的作用是
检验二氧化硫是否除尽
检验二氧化硫是否除尽
.(4)认为气体Y中还含有Q的理由是
C+2H2SO4(浓硫酸)
CO2 ↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓硫酸)
CO2 ↑+2SO2↑+2H2O
(用化学方程式表示).
| ||
(5)为确认Q的存在,需在装置中添加M于
c
c
(选填序号).a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是
D中固体由黑色变红和E中固体由白变蓝.
D中固体由黑色变红和E中固体由白变蓝.
.(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28ml H2),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由
否,用托盘天平无法称量D或E的差量.
否,用托盘天平无法称量D或E的差量.
.(2010?福建)硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:
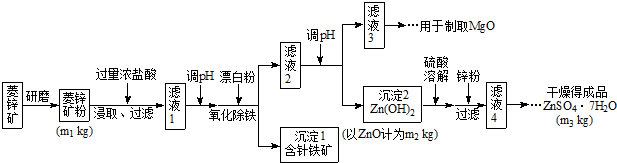
(1)将菱锌矿研磨成粉的目的是
(2)完成“氧化除铁”步骤中反应的离子方程式:
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于
.
查看习题详情和答案>>

(1)将菱锌矿研磨成粉的目的是
增大反应物接触面积或增大反应速率或使反应更充分
增大反应物接触面积或增大反应速率或使反应更充分
.(2)完成“氧化除铁”步骤中反应的离子方程式:
2
2
Fe(OH)2+ClO-
ClO-
+H2O
H2O
═2
2
Fe(OH)3+1
1
Cl-(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是
FeO(OH)
FeO(OH)
.(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为
8.0≤pH<10.4
8.0≤pH<10.4
.| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
bd
bd
(选填序号).a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为
蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
、过滤,洗涤,干燥.(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于
| 125m2 |
| 81m1 |
| 125m2 |
| 81m1 |