网址:http://m.1010jiajiao.com/timu_id_3930699[举报]
CH3COOH![]() CH3COO-+H+(电离平衡)
CH3COO-+H+(电离平衡)
Ca(OH)2(s) ![]() Ca2++2OH-(溶解平衡)
Ca2++2OH-(溶解平衡)
*Fe3++SCN-![]() [Fe(SCN)]2+(络合平衡)等
[Fe(SCN)]2+(络合平衡)等
难溶于水的盐在水中存在溶解平衡,其饱和溶液(达到溶解平衡时的溶液)中各离子的浓度遵循一定的定量关系。例如AgCl在水中存在平衡:AgCl![]() Ag++Cl-,在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示,Ksp=c(Ag+)·c(Cl-)。已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)
Ag++Cl-,在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示,Ksp=c(Ag+)·c(Cl-)。已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)![]() Ca2++2OH-,CaCO3(s)
Ca2++2OH-,CaCO3(s)![]() Ca2++CO
Ca2++CO![]() 。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
思考:(1)写出上述两个反应的化学方程式。
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由。
查看习题详情和答案>>用化学反应速率与化学平衡及平衡移动的原理可以分析诸类平衡,如:(电离平衡)CH3COOH![]() CH3COO-+H+、(溶解平衡)Ca(OH)2(s)
CH3COO-+H+、(溶解平衡)Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)、(络合平衡)Fe3++SCN-=[Fe(SCN)]2+等.难溶于水的盐在水中存在溶解平衡,其饱和溶液(达到溶解平衡时的溶液)中各离子的浓度遵循一定的定量关系.例如AgCl在水中存在平衡:AgCl
Ca2+(aq)+2OH-(aq)、(络合平衡)Fe3++SCN-=[Fe(SCN)]2+等.难溶于水的盐在水中存在溶解平衡,其饱和溶液(达到溶解平衡时的溶液)中各离子的浓度遵循一定的定量关系.例如AgCl在水中存在平衡:AgCl![]() Ag++Cl-.在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示Ksp=c(Ag+)·c(Cl-).已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)
Ag++Cl-.在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示Ksp=c(Ag+)·c(Cl-).已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq);2CaCO3(s)
Ca2+(aq)+2OH-(aq);2CaCO3(s)![]()
![]() .在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
.在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
思考题:
(1)写出上述两个反应的化学方程式.
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由.
氮元素可形成卤化物、叠氮化物及络合物等.
(1)NF3构型为三角锥体,沸点-129℃;可在铜催化作用下由F2和过量NH3反应得到.
NF3属于
| ||
| ||
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-.
①与N3-互为等电子体的分子、离子有:
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:Co[(N3)(NH3)5]SO4、Fe(CN)64-.写出钴原子在基态时的价电子排布式:
Co[(N3)(NH3)5]SO4中钴的配位数为
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体具有水的可溶性,则此种化合物是
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是
A.NaN3与KN3结构类似,前者晶格能较小
B.第一电离能(I1):N>P>S
C.钠晶胞结构如图,该晶胞分摊2个钠原子
D.氮气常温下很稳定,是因为氮的电负性小.
Ⅰ.甲组方案:
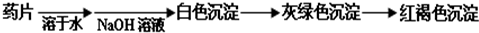
(提示:白色的Fe(OH)2在空气中会迅速变成灰绿色,最后变成红褐色)
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果.分析甲组实验失败的可能原因:
Ⅱ.乙组同学在参考书上查得如下资料:
①人体胃液中有大量盐酸,能溶解多种物质.
②H2O2不稳定,光照、加热和微量杂质会促使其分解;H2O2中氧元素为-1价,它既有氧化性又有还原性.
他们认真思考了甲组实验失败的原因,模拟药服用后在人体中溶解的变化过程,重新设计并完成下列实验:
乙组方案:
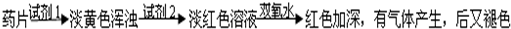
(1)试剂1为:
(2)加入试剂2后,溶液显淡红色的原因是:
(3)加双氧水后,红色加深的原因是:
Ⅲ.丙组同学对乙组实验中最后红色褪去的现象产生了浓厚的兴趣,欲探究其褪色的原因.根据粒子的组成,他们认为有两种可能原因:①[Fe(SCN)]2+中的三价铁被还原为亚铁;②
请你对其中一种可能进行实验验证:
实验方案(用文字叙述):
根据预期现象判断结论:
或在褪色后溶液中加入KSCN溶液
现象:变红色结论:褪色原因是因为②;不变红色结论:褪色原因是因为①
或在褪色后溶液中加入KSCN溶液
现象:变红色结论:褪色原因是因为②;不变红色结论:褪色原因是因为①