摘要:25 ℃时.pH=3的盐酸a L分别与下列三种溶液充分混合后.溶液均呈中性:①c(NH3·H2O)=10-3 mol·-1L的氨水b L,②c(OH-)=10-3 mol·-1L的氨水c L,③c(OH-)=10-3 mol·-1L的Ba(OH)2溶液d L.试判断a.b.c.d的数量大小关系为( ) A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
网址:http://m.1010jiajiao.com/timu_id_3929589[举报]
 Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为
Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为A.5 B.1 C.1~3之间D.3~5之间
(2)常温下,pH=3的盐酸和pH=11的氨水等体积混合后,混合溶液中c(Cl-)
(3)常温下,已知某CH3COONa溶液中的c(Na+)=c(CH3COO一),则该溶液的pH
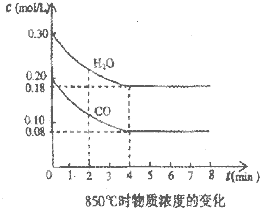
Ⅱ、在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图:
(1)0一4min的平均反应速率v(CO)=
(2)850℃时,平衡常数K=
(3)下列措施中能使n(H2)/n(CO)增大的是
A.降低温度 B.充入He(g),使体系压强增大
C.将CO2 (g)从体系中分离 D.再充入0.2mol CO和0.3mol H2.
(2013?南通一模)工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示.回答下列问题:
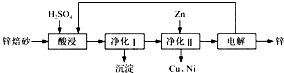
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀.
①写出酸性条件下H2O2与Fe 2+反应的离子方程式:
②25℃时,pH=3的溶液中,c(Fe3+)=
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是
(4)本流程中可以循环利用的物质除锌外还有
查看习题详情和答案>>

(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O
ZnFe2O4+4H2SO4═ZnSO4+Fe2(SO4)3+4H2O
.(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀.
①写出酸性条件下H2O2与Fe 2+反应的离子方程式:
H2O2+2Fe2++2H+═2Fe3++2H2O
H2O2+2Fe2++2H+═2Fe3++2H2O
.②25℃时,pH=3的溶液中,c(Fe3+)=
4.0×10-5
4.0×10-5
mol?L-1(已知25℃,Ksp[Fe( OH)3]=4.0×10-38).③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
Fe(OH)3胶体(沉淀)具有吸附性
Fe(OH)3胶体(沉淀)具有吸附性
.(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是
制取的锌含铜等杂质
制取的锌含铜等杂质
.(4)本流程中可以循环利用的物质除锌外还有
H2SO4、ZnSO4
H2SO4、ZnSO4
.