摘要:⊿“kJ·mol-1 .表示的是摩尔反应热.即按照所给反应式发生1mol反应时吸收或放出的热量. ⊿注意单位中“kJ·mol-1 .这里的“1mol 是指所给反应式发生1mol反应.不是指具体反应物或生成物的分子.是指所给这个反应这些微粒的“特定组合 为1mol 如H2(g)+1/2O2(g)=H2O(g),△H=-241.8kJ/mol. 每mol该反应的热效应是-241.8kJ/mol.或者说是每mol该反应放出热量为241.8kJ.这里的每mol是指“H2(g)+1/2O2(g)=H2O(g) 为1mol 练习: 在101kPa和25℃时.有反应的热化学方程式: H2(g)+1/2O2(g)=H2O(g),△H=-241.8kJ/mol. H2(g)+1/2O2(g)=H2O(l),△H=-285.8 kJ/mol.
网址:http://m.1010jiajiao.com/timu_id_3927066[举报]
19世纪丹麦学者尤利乌斯?托姆森得到一个计算CuCI2?2H2O在水中溶解热效应(△H)的式子,当所得溶液中每1 mol CuCl2有x mol水时,所产生的热效应△H=[3. 35一21. 02× (x一10)/( x+11.24) ]kJ (△H<0,表明反应放热,△H>0,表明反应吸热![]() 。2 0 °C时(此时饱和溶液中每l00 g水含无水氯化铜74. 5g), 每摩尔氯化铜溶解的热效应与
。2 0 °C时(此时饱和溶液中每l00 g水含无水氯化铜74. 5g), 每摩尔氯化铜溶解的热效应与 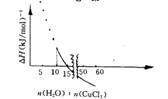 所形成饱和溶液中含水量的关系如下图所示
所形成饱和溶液中含水量的关系如下图所示
x = n(H2O)n(CuCl2)
则下列叙述不正确的是
A.仅根据题目所给信息,无法算出2 0 °C时CuCl2饱和溶液的物质的量浓度
B.CuCl2?2H2O溶于水是放热的
C.在极稀的溶液中,即当x趋向无穷大时,1 mol氯化铜溶解时放出17.67 kJ热量
D.当x<10时,因CuCI2不能完全溶解,上图无物理意义
查看习题详情和答案>>