摘要:工业上制备纯硅反应的热化学方程式如下:SiClx(g)+2H2;ΔH=+Q kJ·mo-1L某温度.压强下.将一定量反应物通入密闭容器进行以上反应.下列叙述正确的是( ) A.反应过程中.若增大压强能提高SiClx的转化率 B.若反应开始时SiCl4为1 mol,则达平衡时.吸收热量为Q kJ C.反应至4 min时.若HCl浓度为0.12 mol·-1L.则H2的反应速率为0.03 mol·-1L·miN-1 D.当反应吸收热量为0.025Q kJ时.生成的HCl通入100 mL 1 mol·-1L的NaOH溶液恰好反应
网址:http://m.1010jiajiao.com/timu_id_3925826[举报]
(2008年北京卷,理综,27)(3)用图示装置制备NO并验证其还原性。有下列主要操作:
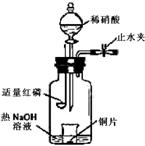 a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ____________________________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是_____________________________________
______________________________________________________________________。反应的离子方程式是____________________________________________________。
查看习题详情和答案>> (08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()
(08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()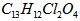
 溶液发生显色反应
溶液发生显色反应