摘要:打开盛有浓盐酸的玻璃瓶塞.观察到瓶口有白雾.这是( ) A. 氯化氢气体 B.水蒸气 C.盐酸气体 D.盐酸小液滴
网址:http://m.1010jiajiao.com/timu3_id_99840[举报]
某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.
提出问题 这种淡黄色粉末是什么?有什么性质和用途?
查阅资料 ①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,溶于水并能与水反应,“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”
猜想与探究
猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
实验与结论
提出问题 过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
提出猜想 过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气.
进行实验
实验Ⅰ:验证过氧化钠与氮气反应并生成氧气. 王轩同学设计如图Ⅰ所示装置:
(1)实验现象及结论:观察到______现象,判断过氧化钠与氮气没有发生反应.
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气. 华宇同学设计了如下图所示装置
(2)其中A装置的作用是______.
(3)实验现象及结论:带火星的木条复燃;查阅资料知道:过氧化钠与水蒸气生成了氧气和一种常见碱,写出该反应的化学方程式______.
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气.
李杰在老师的指导下也设计了如图Ⅱ所示装置.(不考虑稀盐酸的挥发)
(4)实验记录
实验反思
(1)张红同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是______.请你回答如何改进该实验______.
(2)王兵同学查阅资料后知道实验Ⅲ中过氧化钠与二氧化碳反应生成碳酸钠和氧气,他称取过氧化钠与二氧化碳充分反应后的固体剩余物质21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图Ⅳ所示(不考虑实验过程中其它因素的影响).
请计算碳酸钠的质量分数:______.(写出计算过程,结果保留一位小数)
查看习题详情和答案>>
提出问题 这种淡黄色粉末是什么?有什么性质和用途?
查阅资料 ①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,溶于水并能与水反应,“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”
猜想与探究
猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
实验与结论
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水,充分振荡 | ______ | 猜想a、c不成立,猜想b成立. |
提出猜想 过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气.
进行实验
实验Ⅰ:验证过氧化钠与氮气反应并生成氧气. 王轩同学设计如图Ⅰ所示装置:

(1)实验现象及结论:观察到______现象,判断过氧化钠与氮气没有发生反应.
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气. 华宇同学设计了如下图所示装置
(2)其中A装置的作用是______.
(3)实验现象及结论:带火星的木条复燃;查阅资料知道:过氧化钠与水蒸气生成了氧气和一种常见碱,写出该反应的化学方程式______.
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气.
李杰在老师的指导下也设计了如图Ⅱ所示装置.(不考虑稀盐酸的挥发)
(4)实验记录
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性. 向装置中加入药品. | 装置的气密性良好. | |
| ② | 打开分液漏斗活塞,向A 装置中缓慢加入稀盐酸. | A装置中观察到的现象有______, C装置中有气泡出现. | A装置中发生反应的化学方程式为______; C装置作用是______. |
| ③ | 一段时间后用带火星的木条在D内进行检验. | 带火星的木条复燃. | 过氧化钠与二氧化碳反应并生成氧气. |
(1)张红同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是______.请你回答如何改进该实验______.
(2)王兵同学查阅资料后知道实验Ⅲ中过氧化钠与二氧化碳反应生成碳酸钠和氧气,他称取过氧化钠与二氧化碳充分反应后的固体剩余物质21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图Ⅳ所示(不考虑实验过程中其它因素的影响).
请计算碳酸钠的质量分数:______.(写出计算过程,结果保留一位小数)

查看习题详情和答案>>
某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.
提出问题 这种淡黄色粉末是什么?有什么性质和用途?
查阅资料 ①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,溶于水并能与水反应,“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”
猜想与探究
猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
实验与结论
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水,充分振荡 | ________ | 猜想a、c不成立,猜想b成立. |
提出猜想 过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气.
进行实验
实验Ⅰ:验证过氧化钠与氮气反应并生成氧气. 王轩同学设计如图Ⅰ所示装置:

(1)实验现象及结论:观察到________现象,判断过氧化钠与氮气没有发生反应.
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气. 华宇同学设计了如下图所示装置
(2)其中A装置的作用是________.
(3)实验现象及结论:带火星的木条复燃;查阅资料知道:过氧化钠与水蒸气生成了氧气和一种常见碱,写出该反应的化学方程式________.
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气.
李杰在老师的指导下也设计了如图Ⅱ所示装置.(不考虑稀盐酸的挥发)
(4)实验记录
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性. 向装置中加入药品. | 装置的气密性良好. | |
| ② | 打开分液漏斗活塞,向A 装置中缓慢加入稀盐酸. | A装置中观察到的现象有________, C装置中有气泡出现. | A装置中发生反应的化学方程式为________; C装置作用是________. |
| ③ | 一段时间后用带火星的木条在D内进行检验. | 带火星的木条复燃. | 过氧化钠与二氧化碳反应并生成氧气. |
(1)张红同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是________.请你回答如何改进该实验________.
(2)王兵同学查阅资料后知道实验Ⅲ中过氧化钠与二氧化碳反应生成碳酸钠和氧气,他称取过氧化钠与二氧化碳充分反应后的固体剩余物质21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图Ⅳ所示(不考虑实验过程中其它因素的影响).
请计算碳酸钠的质量分数:________.(写出计算过程,结果保留一位小数)
 查看习题详情和答案>>
查看习题详情和答案>>
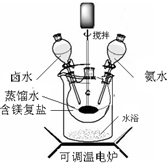 碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.
碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.【探究一】碱式碳酸镁的制备
碱式碳酸镁可用复盐MgCO3?(NH4)2CO3?H2O作原料制备.取一定量的该复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始分解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120℃干燥得到碱式碳酸镁产品.
回答下列问题:
(1)①搅拌的目的是
反应物充分混合接触,提高反应速率
反应物充分混合接触,提高反应速率
;②选择水浴加热方式,其优点是反应物均匀受热
反应物均匀受热
.(2)所得碱式碳酸镁产品中常检出有少量Cl-,其原因是混有
NH4Cl
NH4Cl
(填化学式).(3)设计实验检验碱式碳酸镁中含有Cl-
| 实验操作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸. ②再向上述所得溶液加 硝酸银或AgNO3 硝酸银或AgNO3 溶液 |
现象① 产生气泡 产生气泡 ;现象② 产生白色沉淀 产生白色沉淀 ; |
含有 Cl- |
300℃
已知:碱式碳酸镁分解反应方程式为:xMgCO3?yMg(OH)2?zH2O
| ||
探究小组利用下图测定xMgCO3?yMg(OH)2?zH2O组成.
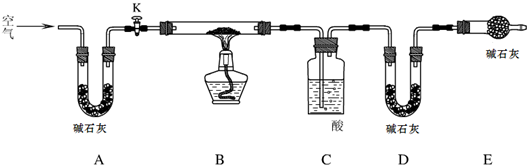
实验步骤:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:
打开活塞K,再次鼓入空气
打开活塞K,再次鼓入空气
(请补充该步操作内容).步骤5:称量相关装置的质量.
某同学在实验过程中采集了如下数据:
A.反应前玻璃管的质量100.0g
B.反应后玻璃管与残留固体总质量120.0g
C.装置C实验后增重9.0g
D.装置D实验后增重17.6g
回答下列问题:
(1)检查整套实验装置气密性的方法如下:将装置A的左端、装置E的右端分别接上导管,放入盛有水的烧杯中,
打开活塞K开关
打开活塞K开关
,对装置B用酒精灯微热,观察,若若两端导管口处均出现气泡
若两端导管口处均出现气泡
,则气密性良好;(2)如果没有装置A,则测定得到的Z值
偏大
偏大
(填“偏大”、“偏小”、“无影响”),装置C中的酸为
浓硫酸
浓硫酸
(写名称);(3)根据实验测定的数据,求出碱式碳酸铜(xMgCO3?yMg(OH)2?zH2O)
中x:y:z=
4:1:4
4:1:4
(要求写出过程).【交流反思】
(4)如果不称量装置C实验前后的增重,要根据实验数据,求出x:y:z的值,还可测量的实验数据是
样品的质量
样品的质量
.某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.
提出问题 这种淡黄色粉末是什么?有什么性质和用途?
查阅资料 ①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,溶于水并能与水反应,“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”
猜想与探究
猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
实验与结论
提出问题 过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
提出猜想 过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气.
进行实验
实验Ⅰ:验证过氧化钠与氮气反应并生成氧气. 王轩同学设计如图Ⅰ所示装置:
(1)实验现象及结论:观察到
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气. 华宇同学设计了如下图所示装置
(2)其中A装置的作用是
(3)实验现象及结论:带火星的木条复燃;查阅资料知道:过氧化钠与水蒸气生成了氧气和一种常见碱,写出该反应的化学方程式
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气.
李杰在老师的指导下也设计了如图Ⅱ所示装置.(不考虑稀盐酸的挥发)
(4)实验记录
实验反思
(1)张红同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是
(2)王兵同学查阅资料后知道实验Ⅲ中过氧化钠与二氧化碳反应生成碳酸钠和氧气,他称取过氧化钠与二氧化碳充分反应后的固体剩余物质21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图Ⅳ所示(不考虑实验过程中其它因素的影响).
请计算碳酸钠的质量分数:
查看习题详情和答案>>
提出问题 这种淡黄色粉末是什么?有什么性质和用途?
查阅资料 ①硫是淡黄色粉末,不溶于水;
②过氧化钠(Na2O2)是淡黄色粉末,溶于水并能与水反应,“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”
猜想与探究
猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
实验与结论
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水,充分振荡 | 固体粉末全部溶解 固体粉末全部溶解 |
猜想a、c不成立,猜想b成立. |
提出猜想 过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气.
进行实验
实验Ⅰ:验证过氧化钠与氮气反应并生成氧气. 王轩同学设计如图Ⅰ所示装置:

(1)实验现象及结论:观察到
燃着的木条熄灭
燃着的木条熄灭
现象,判断过氧化钠与氮气没有发生反应.实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气. 华宇同学设计了如下图所示装置
(2)其中A装置的作用是
产生二氧化碳气体
产生二氧化碳气体
.(3)实验现象及结论:带火星的木条复燃;查阅资料知道:过氧化钠与水蒸气生成了氧气和一种常见碱,写出该反应的化学方程式
2Na2O2+2H2O=4NaOH+3O2↑
2Na2O2+2H2O=4NaOH+3O2↑
.实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气.
李杰在老师的指导下也设计了如图Ⅱ所示装置.(不考虑稀盐酸的挥发)
(4)实验记录
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性. 向装置中加入药品. |
装置的气密性良好. | |
| ② | 打开分液漏斗活塞,向A 装置中缓慢加入稀盐酸. |
A装置中观察到的现象有 有大量的气泡产生 有大量的气泡产生 ,C装置中有气泡出现. |
A装置中发生反应的化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ ;C装置作用是 除去没有反应的二氧化碳 除去没有反应的二氧化碳 . |
| ③ | 一段时间后用带火星的木条在D内进行检验. | 带火星的木条复燃. | 过氧化钠与二氧化碳反应并生成氧气. |
(1)张红同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是
产生的二氧化碳气体中含有水蒸气
产生的二氧化碳气体中含有水蒸气
.请你回答如何改进该实验在A和B之间增加一个装有浓硫酸的装置
在A和B之间增加一个装有浓硫酸的装置
.(2)王兵同学查阅资料后知道实验Ⅲ中过氧化钠与二氧化碳反应生成碳酸钠和氧气,他称取过氧化钠与二氧化碳充分反应后的固体剩余物质21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图Ⅳ所示(不考虑实验过程中其它因素的影响).
请计算碳酸钠的质量分数:
98.6%
98.6%
.(写出计算过程,结果保留一位小数)