摘要:稀释某溶液时,下列量不变的是 ( ) A.溶剂的质量 B.溶质的质量 C.溶液的质量 D.溶质的质量
网址:http://m.1010jiajiao.com/timu3_id_98837[举报]
化学物质之间的反应奥妙无穷.在一次化学探究活动中,同学们从不同角度对稀硫酸与氢氧化钠溶液的反应进行了探究,请你参与并填写以下空白.
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
①请你分析上述方案中为什么强调只有测得的PH≥7才能证明反应发生了?
②写出稀硫酸与氢氧化钠溶液反应的化学方程式
(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
(3)探究稀硫酸与氢氧化钠溶液是否恰好完全反应
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
此时有同学提出方案二不能证明稀硫酸与氢氧化钠溶液恰好完全反应,其原因是
能力提升:
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl2?6H2O)).
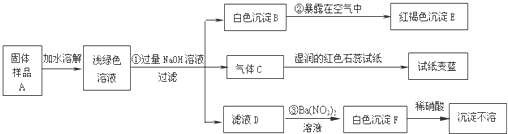
试回答下列问题:
(1)写出下列物质的化学式:C
(2)写出下列变化的化学方程式:
②
(3)上述探究结果说明样品A中含有的离子有
查看习题详情和答案>>
(1)如何用实验验证稀硫酸与氢氧化钠溶液发生了反应
第一组同学设计了实验方案一:
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 |
稀硫酸与氢氧化钠溶液能发生反应 |
排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大
排除因氢氧化钠溶液的加入,稀释硫酸而引起PH变大
或只有PH≥7才能说明硫酸已经反应掉了
或只有PH≥7才能说明硫酸已经反应掉了
.②写出稀硫酸与氢氧化钠溶液反应的化学方程式
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
.(2)设计实验,探究稀硫酸与氢氧化钠溶液的反应是否放热
实验仪器与药品:10%的硫酸、10%的氢氧化钠溶液、烧杯、温度计、玻璃棒、胶头滴管.
请你完成实验方案设计:
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
第二组同学在做完稀硫酸与氢氧化钠溶液反应的实验后,为探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
设计了实验方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若 生成蓝色沉淀 生成蓝色沉淀 |
氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);
若盐酸过量,加入硫酸铜溶液时也无明显现象(或硫酸可能有剩余);
.为此,还需要选择紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等).
紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等).
(填一种试剂),再进行实验即可.能力提升:
某地新建一化工厂有一种产品属于“复盐”,该产品可用作铁树、棕榈等花木的肥料.某化学课外兴趣小组探究该产品的组成,进行了如下的实验:(查阅资料获知:“复盐”是指由两种阳离子和一种酸根离子组成的盐.如光卤石(KCl?MgCl2?6H2O)).

试回答下列问题:
(1)写出下列物质的化学式:C
NH3
NH3
、EFe(OH)3
Fe(OH)3
、FBaSO4
BaSO4
(2)写出下列变化的化学方程式:
②
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
③Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3
(3)上述探究结果说明样品A中含有的离子有
Fe2+、NH4+、SO42-
Fe2+、NH4+、SO42-
.
某化学研究性学习小组参加社会社会实践调查得知:某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程.
[工艺流程示意图]
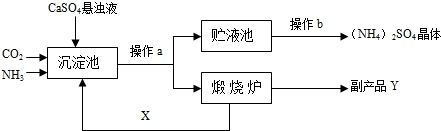
上述流程中,沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
[讨论交流]
(1)操作a的名称是 ,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需要 .
(2)经操作a后得到的某物质在煅烧炉中发生反应的化学方程式为 .该工艺中,X在沉淀池中被消耗,在煅烧炉中又生成,故X可循环使用.X的填化学式为 .
(3)图中操作b应怎样进行呢?
查阅资料:右图是硫酸铵在水中的溶解度曲线.
表:固体硫酸铵在部分温度时的溶解度.
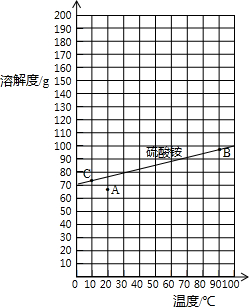
下列说法正确的有 .
①从溶解度曲线中,可以查找70℃时硫酸铵的溶解度约90g;②图中的A点表示硫酸铵溶液的状态不饱和;③若将A点变成B点的操作采用加热蒸发、使溶液浓缩的方法④若将B点转化为C点时,采用的是冷却热饱和溶液方法
该化肥厂生产的硫酸铵化肥品质怎样呢?
[查阅资料]下表是硫酸铵化肥品质的主要指标.
氨气极易溶于水,其水溶液为氨水,呈碱性.
已知:(NH4)2SO4+2NaOH
Na2SO4+2NH3↑+2H2O
[观察外观]该硫酸铵化肥无可见机械杂质.
[实验探究]按如图所示装置进行实验.
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)选择右图装置A进行实验的原因 ,烧杯中盛放的试剂稀硫酸可以吸收氨气,两者化合生成一种盐,写出化学方程式 .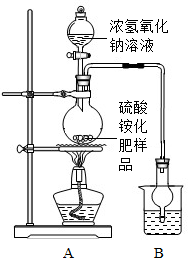
[交流讨论]
甲同学认为:应在实验装置中A、B装置间加装一个干燥装置,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能 (填“偏高”或“偏低”).
乙同学认为:改进后的实验装置中还存在另一个明显缺陷是: .
(经过大家充分讨论后,对实验装置进行了改进,重新进行实验.)
[探究结论]称取13.5 g硫酸铵化肥样品,用最终改进后的实验装置重新进行实验,经数据处理释放出氨气的质量与反应时间如图所示.试通过计算,判断该化肥的等级. (要求写出计算过程)
查看习题详情和答案>>
[工艺流程示意图]

上述流程中,沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
[讨论交流]
(1)操作a的名称是
(2)经操作a后得到的某物质在煅烧炉中发生反应的化学方程式为
(3)图中操作b应怎样进行呢?
查阅资料:右图是硫酸铵在水中的溶解度曲线.
表:固体硫酸铵在部分温度时的溶解度.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |

下列说法正确的有
①从溶解度曲线中,可以查找70℃时硫酸铵的溶解度约90g;②图中的A点表示硫酸铵溶液的状态不饱和;③若将A点变成B点的操作采用加热蒸发、使溶液浓缩的方法④若将B点转化为C点时,采用的是冷却热饱和溶液方法
该化肥厂生产的硫酸铵化肥品质怎样呢?
[查阅资料]下表是硫酸铵化肥品质的主要指标.
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
已知:(NH4)2SO4+2NaOH
| ||
[观察外观]该硫酸铵化肥无可见机械杂质.
[实验探究]按如图所示装置进行实验.
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)选择右图装置A进行实验的原因

[交流讨论]
甲同学认为:应在实验装置中A、B装置间加装一个干燥装置,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能
乙同学认为:改进后的实验装置中还存在另一个明显缺陷是:
(经过大家充分讨论后,对实验装置进行了改进,重新进行实验.)
[探究结论]称取13.5 g硫酸铵化肥样品,用最终改进后的实验装置重新进行实验,经数据处理释放出氨气的质量与反应时间如图所示.试通过计算,判断该化肥的等级.
某化学研究性学习小组参加社会社会实践调查得知:某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程.
[工艺流程示意图]

上述流程中,沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
[讨论交流]
(1)操作a的名称是______,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需要______.
(2)经操作a后得到的某物质在煅烧炉中发生反应的化学方程式为______.该工艺中,X在沉淀池中被消耗,在煅烧炉中又生成,故X可循环使用.X的填化学式为______.
(3)图中操作b应怎样进行呢?
查阅资料:右图是硫酸铵在水中的溶解度曲线.
表:固体硫酸铵在部分温度时的溶解度.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |

下列说法正确的有______.
①从溶解度曲线中,可以查找70℃时硫酸铵的溶解度约90g;②图中的A点表示硫酸铵溶液的状态不饱和;③若将A点变成B点的操作采用加热蒸发、使溶液浓缩的方法④若将B点转化为C点时,采用的是冷却热饱和溶液方法
该化肥厂生产的硫酸铵化肥品质怎样呢?
[查阅资料]下表是硫酸铵化肥品质的主要指标.
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
已知:(NH4)2SO4+2NaOH
 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O[观察外观]该硫酸铵化肥无可见机械杂质.
[实验探究]按如图所示装置进行实验.
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)选择右图装置A进行实验的原因______,烧杯中盛放的试剂稀硫酸可以吸收氨气,两者化合生成一种盐,写出化学方程式______.

[交流讨论]
甲同学认为:应在实验装置中A、B装置间加装一个干燥装置,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能______(填“偏高”或“偏低”).
乙同学认为:改进后的实验装置中还存在另一个明显缺陷是:______.
(经过大家充分讨论后,对实验装置进行了改进,重新进行实验.)
[探究结论]称取13.5 g硫酸铵化肥样品,用最终改进后的实验装置重新进行实验,经数据处理释放出氨气的质量与反应时间如图所示.试通过计算,判断该化肥的等级.______(要求写出计算过程) 查看习题详情和答案>>
氧化物、酸、碱、盐都是重要的无机化合物.请按要求回答下列一系列相关的问题.
(1)产生下列现象,只和空气中的水蒸气有关的是______
A.固体烧碱要密封存放
B.生石灰长期在空气中放置会变质
C.浓硫酸露置于空气中会增重、变稀
D.铁制品放在潮湿空气中会生锈
(2)以下是一些食物的近似pH,对于胃酸过多的人比较适宜的食物是______
| 选项 | A | B | C | D |
| 物质 | 橘子 | 泡菜 | 葡萄 | 玉米粥 |
| pH | 2.9~3.5 | 3.0~4.0 | 3.5~4.5 | 6.8-8.0 |
A.稀释浓硫酸时,为什么不可将水倒进浓硫酸里?请简要解释其原因.
B.盐酸等许多酸都能使紫色石蕊试液变红,为什么?
C.写出用稀盐酸除水垢(主要成分是碳酸钙)的化学方程式.
(4)三支试管中分别装有少量白色固体,它们分别是氯化钠、氢氧化钠、碳酸钙中的一种,只要加入足量的______就能将它们一次性鉴别出来;盐酸(分析纯)化学式HCl质量分数36%密度l.18g/cm3
(5)实验操作考试时某同学做了如下两个实验:①氧化铜与稀硫酸反应;②烧碱溶液与酚酞溶液反应.实验结束后,该同学发现废液缸中有蓝色沉淀.请你写出有蓝色沉淀生成的反应的化学方程式是______.
(6)右图是浓盐酸试剂瓶上标签的部分内容.请回答:
A.现要配制9%的稀盐酸120g,需要这种浓盐酸______g;
B.浓盐酸使用一段时间后溶质质量分数变小的原因是什么?
C.某固体氢氧化钠在空气中敞口放置一段时间后部分变质,将该固体取10g加入质量分数为9%的盐酸至不再产生气泡为止,共产生气体质量为2.2g,试计算未变质的氢氧化钠的质量为多少克? 查看习题详情和答案>>
(2011?平顶山二模)氧化物、酸、碱、盐都是重要的无机化合物.请按要求回答下列一系列相关的问题.
(1)产生下列现象,只和空气中的水蒸气有关的是______
A.固体烧碱要密封存放
B.生石灰长期在空气中放置会变质
C.浓硫酸露置于空气中会增重、变稀
D.铁制品放在潮湿空气中会生锈
(2)以下是一些食物的近似pH,对于胃酸过多的人比较适宜的食物是______
(3)根据“性质决定用途,用途体现性质”回答下列问题.
A.稀释浓硫酸时,为什么不可将水倒进浓硫酸里?请简要解释其原因.
B.盐酸等许多酸都能使紫色石蕊试液变红,为什么?
C.写出用稀盐酸除水垢(主要成分是碳酸钙)的化学方程式.
(4)三支试管中分别装有少量白色固体,它们分别是氯化钠、氢氧化钠、碳酸钙中的一种,只要加入足量的______就能将它们一次性鉴别出来;盐酸(分析纯)化学式HCl质量分数36%密度l.18g/cm3
(5)实验操作考试时某同学做了如下两个实验:①氧化铜与稀硫酸反应;②烧碱溶液与酚酞溶液反应.实验结束后,该同学发现废液缸中有蓝色沉淀.请你写出有蓝色沉淀生成的反应的化学方程式是______.
(6)右图是浓盐酸试剂瓶上标签的部分内容.请回答:
A.现要配制9%的稀盐酸120g,需要这种浓盐酸______g;
B.浓盐酸使用一段时间后溶质质量分数变小的原因是什么?
C.某固体氢氧化钠在空气中敞口放置一段时间后部分变质,将该固体取10g加入质量分数为9%的盐酸至不再产生气泡为止,共产生气体质量为2.2g,试计算未变质的氢氧化钠的质量为多少克?
查看习题详情和答案>>
(1)产生下列现象,只和空气中的水蒸气有关的是______
A.固体烧碱要密封存放
B.生石灰长期在空气中放置会变质
C.浓硫酸露置于空气中会增重、变稀
D.铁制品放在潮湿空气中会生锈
(2)以下是一些食物的近似pH,对于胃酸过多的人比较适宜的食物是______
| 选项 | A | B | C | D |
| 物质 | 橘子 | 泡菜 | 葡萄 | 玉米粥 |
| pH | 2.9~3.5 | 3.0~4.0 | 3.5~4.5 | 6.8-8.0 |
A.稀释浓硫酸时,为什么不可将水倒进浓硫酸里?请简要解释其原因.
B.盐酸等许多酸都能使紫色石蕊试液变红,为什么?
C.写出用稀盐酸除水垢(主要成分是碳酸钙)的化学方程式.
(4)三支试管中分别装有少量白色固体,它们分别是氯化钠、氢氧化钠、碳酸钙中的一种,只要加入足量的______就能将它们一次性鉴别出来;盐酸(分析纯)化学式HCl质量分数36%密度l.18g/cm3
(5)实验操作考试时某同学做了如下两个实验:①氧化铜与稀硫酸反应;②烧碱溶液与酚酞溶液反应.实验结束后,该同学发现废液缸中有蓝色沉淀.请你写出有蓝色沉淀生成的反应的化学方程式是______.
(6)右图是浓盐酸试剂瓶上标签的部分内容.请回答:
A.现要配制9%的稀盐酸120g,需要这种浓盐酸______g;
B.浓盐酸使用一段时间后溶质质量分数变小的原因是什么?
C.某固体氢氧化钠在空气中敞口放置一段时间后部分变质,将该固体取10g加入质量分数为9%的盐酸至不再产生气泡为止,共产生气体质量为2.2g,试计算未变质的氢氧化钠的质量为多少克?
查看习题详情和答案>>