摘要:14.按下列要求.填写对应物质的化学式或主要成分的名称: (1)少量存在于人体胃液中,能帮助消化的是 .若胃酸过多.可服用含有 的药物中和胃酸. (2)可用于砌砖.抹墙和降低土壤酸性.也可用于配制农药波尔多液的是 . (3)固体可用作某些气体的干燥剂.具有强烈的腐蚀性的是 . (4)可用作建筑装饰材料的是 .用于煅烧后制取生石灰的是 .同时得到的副产品是 . (5)一种白色固体.加少量水后变蓝的是 .当它从饱和溶液中析出时得到的是 .
网址:http://m.1010jiajiao.com/timu3_id_90258[举报]
粗还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C,可用氢气在高温下进一步还原,其反应方程式为:FexOY+yH2 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4
3Fe+CH4
(1)写出焙烧中氧化铁与CO反应的化学方程式 .
(2)焙烧中加焦炭的作用除了可以生成CO外,还能 .
[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行试验,已知 3CH4+4Fe2O3 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe
(假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).

(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①③ ⑤⑥⑦(填序号);
(4)步骤③的目的是 ,验证该步骤目的达到的实验方法是 ;步骤⑥的目的是
(5)若装置D、E分别增重mg和ng,则m与n的关系为
A.11m=9n B.11m<9n C.11m>9n
若缺少装置D,则所测氧元素的质量分数将 (填“偏大”、“偏小”或“等于”.下同).碳元素的质量分数将 .
(6)粗还原铁粉样品的质量为10.000g,装置B,E分别增重0.180g和0.220g.计算样品中氧和碳元素的质量分数(要求计算过程). 查看习题详情和答案>>
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C,可用氢气在高温下进一步还原,其反应方程式为:FexOY+yH2
 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4
3Fe+CH4(1)写出焙烧中氧化铁与CO反应的化学方程式 .
(2)焙烧中加焦炭的作用除了可以生成CO外,还能 .
[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行试验,已知 3CH4+4Fe2O3
 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe(假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).

(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①③ ⑤⑥⑦(填序号);
(4)步骤③的目的是 ,验证该步骤目的达到的实验方法是 ;步骤⑥的目的是
(5)若装置D、E分别增重mg和ng,则m与n的关系为
A.11m=9n B.11m<9n C.11m>9n
若缺少装置D,则所测氧元素的质量分数将 (填“偏大”、“偏小”或“等于”.下同).碳元素的质量分数将 .
(6)粗还原铁粉样品的质量为10.000g,装置B,E分别增重0.180g和0.220g.计算样品中氧和碳元素的质量分数(要求计算过程). 查看习题详情和答案>>
粗还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C,可用氢气在高温下进一步还原,其反应方程式为:FexOY+yH2 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4
3Fe+CH4
(1)写出焙烧中氧化铁与CO反应的化学方程式 .
(2)焙烧中加焦炭的作用除了可以生成CO外,还能 .
[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行试验,已知 3CH4+4Fe2O3 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe
(假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).

(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①③ ⑤⑥⑦(填序号);
(4)步骤③的目的是 ,验证该步骤目的达到的实验方法是 ;步骤⑥的目的是
(5)若装置D、E分别增重mg和ng,则m与n的关系为
A.11m=9n B.11m<9n C.11m>9n
若缺少装置D,则所测氧元素的质量分数将 (填“偏大”、“偏小”或“等于”.下同).碳元素的质量分数将 .
(6)粗还原铁粉样品的质量为10.000g,装置B,E分别增重0.180g和0.220g.计算样品中氧和碳元素的质量分数(要求计算过程). 查看习题详情和答案>>
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C,可用氢气在高温下进一步还原,其反应方程式为:FexOY+yH2
 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4
3Fe+CH4(1)写出焙烧中氧化铁与CO反应的化学方程式 .
(2)焙烧中加焦炭的作用除了可以生成CO外,还能 .
[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行试验,已知 3CH4+4Fe2O3
 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe(假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).

(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①③ ⑤⑥⑦(填序号);
(4)步骤③的目的是 ,验证该步骤目的达到的实验方法是 ;步骤⑥的目的是
(5)若装置D、E分别增重mg和ng,则m与n的关系为
A.11m=9n B.11m<9n C.11m>9n
若缺少装置D,则所测氧元素的质量分数将 (填“偏大”、“偏小”或“等于”.下同).碳元素的质量分数将 .
(6)粗还原铁粉样品的质量为10.000g,装置B,E分别增重0.180g和0.220g.计算样品中氧和碳元素的质量分数(要求计算过程). 查看习题详情和答案>>
21、(1)请在横线上用恰当的化学用语表示:
①2个氧分子
③硝酸钾的化学式
(2) 氯化钠有着广泛用途,不但是重要的调味品,又是重要的工业原料.
①通过晾晒海水或煮盐井水、盐湖水等均可得到含有较多杂质的氯化钠晶体--粗盐,这种方法属于
②钠与氯气反应时,每个钠原子失去
③氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水(Cl2+2NaOH=NaCl+NaClO+H2O),工业上常用氯气和石灰水反应制漂白粉,其反应原理与上述反应相同,请写出制漂白粉的化学方程式
(3) 下图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和部分生成物 省略).
省略).
请按下列要求填空:
①物质a主要成分的化学式是
②物质b主要成分中阳离子是
③物质c(C6H12O6)所属类别是
④写出由CO2生成物质d的化学反应方程式
⑤标出物质e化学式中带点元素的化合价
查看习题详情和答案>>
①2个氧分子
2O2
,②硫酸根离子SO42-
,③硝酸钾的化学式
KNO3
.(2) 氯化钠有着广泛用途,不但是重要的调味品,又是重要的工业原料.
①通过晾晒海水或煮盐井水、盐湖水等均可得到含有较多杂质的氯化钠晶体--粗盐,这种方法属于
物理
变化(填“物理”或“化学”).粗盐经过溶解
、过滤、蒸发
可得到初步提纯.②钠与氯气反应时,每个钠原子失去
一
个电子形成钠离子(Na+),每个氯原子得到一
个电子形成氯离子(Cl-),Na+与Cl-由于静电作用而结合成NaCl③氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水(Cl2+2NaOH=NaCl+NaClO+H2O),工业上常用氯气和石灰水反应制漂白粉,其反应原理与上述反应相同,请写出制漂白粉的化学方程式
2Cl2+2Ca(OH)2=CaCl2+2H2O+Ca(ClO)2
.(3) 下图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和部分生成物
 省略).
省略).请按下列要求填空:
①物质a主要成分的化学式是
CH4
;②物质b主要成分中阳离子是
Ca2+
;③物质c(C6H12O6)所属类别是
有机化合物
该物质中C、H、O三种元素的质量比是6:1:8
;④写出由CO2生成物质d的化学反应方程式
CO2+H2O=H2CO3
.⑤标出物质e化学式中带点元素的化合价
+1价
. 水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:
水是重要的自然资源,在进行化学实验和溶液中都需要水.请按要求回答下列问题:
(1)下列“水”中属于纯净物的是______.
A.矿泉水 B.雨水 C.蒸馏水 D.自来水
(2)如图1是电解水的实验装置,甲试管中收集到的气体是______.
(3)我国生活饮用水的主要标准为:
| 感官指标 | 化学指标 | 细菌指标 |
| 水质无色无味澄清 | PH:6.5~8.5 | 细菌总个数<100个/mL等 |
(4)水常用作溶剂.公共场所可用过氧乙酸溶液对环境消毒.现有溶质质量分数为15%的过氧乙酸溶液10g,要配制成溶质质量分数为1%的过氧乙酸溶液,需加水______g.
(5)如图2,X、Y两种固体物质在水中的溶解度曲线图.
①60℃时,把45g的X加入50g水中,充分溶解,得到该温度下X的水溶液是______(填“饱和”或“不饱和”)溶液.
②在40℃时,分别将100gX的饱和溶液和200gY的饱和溶液蒸发掉10g水,析出晶体的质量分别为mg和ng,则m______n(填“>”、“=”或“<”).
(6)用水鉴别物质有一定规律,掌握其规律会使学习更轻松.现有四种白色固体,分别是NaOH、CuSO4、NaCl、CaCO3,只提供蒸馏水,将其鉴别开.
①根据是否溶于水和溶于水时形成蓝色溶液,可分别鉴别出______;
②将溶于水时形成的无色溶液的两种物质分为一组,根据溶液温度______(填“升高”、“降低”或“不变”),可鉴别出______.
(7)我市陆良的铬渣污染,主要是重金属铬对水源的污染.镉的化合物氯化镉(CdCl2)也是污染水源的重金属之一,为消除污染,处理方法之一就是加入烧碱,发生复分解反应生成镉的化合物沉淀下来,请写出氯化镉(CdCl2)与烧碱反应的方程式:______.
(8)节假日或双休日,去郊游野炊实为一大快事.然而,在野炊的情趣之中,如果遇到下面一些问题,你是如何怎么处理的?
①野餐食谱如下:主食:馒头 配菜:烤火腿、鲫鱼汤、五香豆干.从营养角度来看,你准备再添-样______;(填字母)A.炒鸡蛋 B.牛奶 C.黄瓜
②郊外通常比较泥泞,如果你的交通工具是自行车,你回来进行清洗后是如何防锈的:______.(填字母)
A.立即晾晒干 B.链条传动部件涂上油 C.涂油漆. 查看习题详情和答案>>
(2011?扬州)粗还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:
粗还原铁粉中还含有少量铁的氧化物和Fe3C,可用氢气在高温下进一步还原,其反应方程式为:FexOY+yH2
xFe+yH2O Fe3C+2H2
3Fe+CH4
(1)写出焙烧中氧化铁与CO反应的化学方程式
(2)焙烧中加焦炭的作用除了可以生成CO外,还能
[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行试验,已知 3CH4+4Fe2O3
3CO2+6H2O+8Fe
(假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).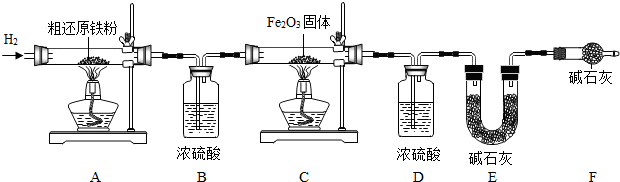
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①③
(4)步骤③的目的是
(5)若装置D、E分别增重mg和ng,则m与n的关系为
A.11m=9n B.11m<9n C.11m>9n
若缺少装置D,则所测氧元素的质量分数将
(6)粗还原铁粉样品的质量为10.000g,装置B,E分别增重0.180g和0.220g.计算样品中氧和碳元素的质量分数(要求计算过程).
查看习题详情和答案>>
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C,可用氢气在高温下进一步还原,其反应方程式为:FexOY+yH2
| ||
| ||
(1)写出焙烧中氧化铁与CO反应的化学方程式
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(2)焙烧中加焦炭的作用除了可以生成CO外,还能
提供热量
提供热量
.[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行试验,已知 3CH4+4Fe2O3
| ||
(假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).

(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①③
④②
④②
⑤⑥⑦(填序号);(4)步骤③的目的是
除去装置内的氧气,防止发生爆炸
除去装置内的氧气,防止发生爆炸
,验证该步骤目的达到的实验方法是收集尾气靠近燃着的酒精灯,听声音
收集尾气靠近燃着的酒精灯,听声音
;步骤⑥的目的是防止生成的还原铁粉再次被氧化,起保护作用
防止生成的还原铁粉再次被氧化,起保护作用
(5)若装置D、E分别增重mg和ng,则m与n的关系为
C
C
A.11m=9n B.11m<9n C.11m>9n
若缺少装置D,则所测氧元素的质量分数将
等于
等于
(填“偏大”、“偏小”或“等于”.下同).碳元素的质量分数将偏大
偏大
.(6)粗还原铁粉样品的质量为10.000g,装置B,E分别增重0.180g和0.220g.计算样品中氧和碳元素的质量分数(要求计算过程).